Arztbrief 2014/2015
Foemig (Diskussion | Beiträge) K |
(→Dokument-Level-Template für den Arztbrief) |
||
| (100 dazwischenliegende Versionen von 3 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| − | {{Underconstruction}} | + | <!--{{Underconstruction}}--> |
<!-- | <!-- | ||
| − | Implementierungsleitfaden "Arztbrief | + | Implementierungsleitfaden "Arztbrief 2014/2015" |
--> | --> | ||
{{Infobox Dokument | {{Infobox Dokument | ||
| − | |Title Arztbrief | + | |Title = Arztbrief 2014/2015<br/>auf Basis der HL7 Clinical Document Architecture Release 2<br/>für das deutsche Gesundheitswesen |
| − | |Short = Arztbrief | + | |Short = Arztbrief 2014/2015 |
|Namespace = cdaab2 | |Namespace = cdaab2 | ||
|Type = Implementierungsleitfaden | |Type = Implementierungsleitfaden | ||
| − | |Version = | + | |Version = 1.00 |
| − | |Submitted = HL7 | + | |Submitted = HL7 Deutschland |
| − | |Date = | + | |Date = 15. Oktober 2015 |
| − | |Copyright = 2013 | + | |Copyright = 2013-2015 |
| − | |Status = | + | |Status = Abgestimmt |
| − | |Period = | + | |Period = Abgestimmt |
|OID = n.n. | |OID = n.n. | ||
|Realm = Deutschland | |Realm = Deutschland | ||
}} | }} | ||
| − | |||
{{Infobox Ballot Begin}} | {{Infobox Ballot Begin}} | ||
| − | {{Ballot | Version = | + | {{Ballot | Version = 0.91 | Date = 15.10.2014 | Status = Abstimmung | Realm = Deutschland | Othericon = x |
| + | | Otherdocuments = http://download.hl7.de/documents/cdar2-arztbrief/Arztbrief2014-v091.pdf | ||
| + | | Comment = | ||
| + | }} | ||
| + | {{Ballot | Version = 0.99 | Date = 15.07.2015 | Status = Kommentarauflösung | Realm = Deutschland | Othericon = x | ||
| + | | Otherdocuments = http://download.hl7.de/documents/cdar2-arztbrief/Arztbrief2014-v099.pdf | ||
| + | | Comment = Zwischenstand nach Kommentarauflösung | ||
| + | }} | ||
| + | {{Ballot | Version = 1.00 | Date = 15.10.2015 | Status = Abgestimmt | Realm = Deutschland | Othericon = x | ||
| + | | Otherdocuments = http://download.hl7.de/documents/cdar2-arztbrief/Arztbrief2014-v100.pdf | ||
| + | | Comment = Finale Version | ||
| + | }} | ||
{{Infobox Ballot End}} | {{Infobox Ballot End}} | ||
| − | {{ | + | {{Infobox Contributors Begin}} |
| − | + | {{Contributor | Logo = Logo-Agfa.jpg | Name = Agfa HealthCare GmbH | Location = Bonn }} | |
| − | }} | + | {{Contributor | Logo = Logo-Hcs.jpg | Name = Heitmann Consulting & Services GmbH | Location = Hürth }} |
| + | {{Contributor | Logo = Logo-BrightOne.jpg | Name = brightOne GmbH (bis Dezember 2013) | Location = Köln }} | ||
| + | {{Contributor | Logo = Logo-Siemens.jpg | Name = Siemens Healthcare | Location = Erlangen }} | ||
| + | {{Contributor | Logo = Logo ztg.gif | Name = ZTG GmbH | Location = Bochum }} | ||
| + | {{Infobox Contributors End}} | ||
| + | =Dokumenteninformationen= | ||
{{HL7transclude| cdaab2:Impressum}} | {{HL7transclude| cdaab2:Impressum}} | ||
| + | {{HL7transclude| cdaab2:Ansprechpartner}} | ||
| + | {{HL7transclude| cdaab2:Disclaimer}} | ||
{{HL7transclude| cdaab2:Autoren}} | {{HL7transclude| cdaab2:Autoren}} | ||
| − | + | {{HL7transclude| cdaab2:Danksagung}} | |
{{HL7transclude| cdaab2:Einleitung}} | {{HL7transclude| cdaab2:Einleitung}} | ||
| − | + | {{HL7transclude| cdaab2:Grundlagen}} | |
| − | {{HL7transclude| cdaab2: | + | {{HL7transclude| cdaab2:Konzept-Modellbeschreibung}} |
| − | {{HL7transclude| cdaab2: | + | {{HL7transclude| cdaab2:Template-Konzept}} |
| − | + | {{HL7transclude| cdaab2:Konformität}} | |
| + | {{HL7transclude| cdaab2:Optionalität}} | ||
| + | {{HL7transclude| cdaab2:Transportaspekte}} | ||
| + | {{HL7transclude| cdaab2:struktureller Aufbau}} | ||
| + | ==CDA R2 Header== | ||
| + | {{HL7transclude| cdaab2:ClinicalDocument}} | ||
| + | {{HL7transclude| cdaab2:Header-Assoziationen}} | ||
| + | {{HL7transclude| cdaab2:Body}} | ||
| + | {{HL7transclude| cdaab2:Textformatierung}} | ||
| + | {{HL7transclude| cdaab2:Datentypen}} | ||
| + | {{HL7transclude| cdaab2:Identifikationen}} | ||
| + | =Templates für den Arztbrief= | ||
{{HL7transclude| cdaab2:Arztbriefstruktur}} | {{HL7transclude| cdaab2:Arztbriefstruktur}} | ||
| + | <div class="landscape"> | ||
| + | =Dokument-Level-Template für den Arztbrief= | ||
| + | {{HL7transclude| cdaab2:CDA-Dokument Arztbrief (clinicaldocument) (Template)}} | ||
| − | {{HL7transclude| cdaab2: | + | =Header-Level-Templates für den Arztbrief= |
| − | {{HL7transclude| cdaab2: | + | {{HL7transclude| cdaab2:Patient (recordTarget) (Template)}} |
| − | {{HL7transclude| cdaab2: | + | {{HL7transclude| cdaab2:Autor (author) (Template)}} |
| − | {{HL7transclude| cdaab2:Empfänger (informationRecipient) ( | + | {{HL7transclude| cdaab2:Autor Person (author) (Template)}} |
| − | {{HL7transclude| cdaab2:Datentypist (dataEnterer) ( | + | {{HL7transclude| cdaab2:verwaltende Organisation (custodian) (Template)}} |
| − | {{HL7transclude| cdaab2: | + | {{HL7transclude| cdaab2:Empfänger (informationRecipient) (Template)}} |
| − | {{HL7transclude| cdaab2: | + | {{HL7transclude| cdaab2:Unterzeichner gesetzlich verantwortlich (legalAuthenticator) (Template)}} |
| − | {{HL7transclude| cdaab2: | + | {{HL7transclude| cdaab2:Unterzeichner (Authenticator) (Template)}} |
| − | {{HL7transclude| cdaab2: | + | {{HL7transclude| cdaab2:Datentypist (dataEnterer) (Template)}} |
| + | {{HL7transclude| cdaab2:Informant (informant) (Template)}} | ||
| + | {{HL7transclude| cdaab2:Weitere Beteiligte (participant) (Template)}} | ||
| + | {{HL7transclude| cdaab2:Einweisender_Arzt (participant) (Template)}} | ||
| + | {{HL7transclude| cdaab2:Hausarzt (participant) (Template)}} | ||
| + | {{HL7transclude| cdaab2:Notfallkontakt (participant) (Template)}} | ||
| + | {{HL7transclude| cdaab2:Angehörige (participant) (Template)}} | ||
| + | {{HL7transclude| cdaab2:Versicherter/Versicherung (participant) (Template)}} | ||
| + | {{HL7transclude| cdaab2:Patientenkontakt (EncompassingEncounter) (Template)}} | ||
| + | <!-- | ||
| + | Sections | ||
| + | --> | ||
| + | =Section-Level-Templates für den Arztbrief= | ||
| + | Ein Arztbrief kann im Body | ||
| + | *entweder unstrukturiert als PDF o.ä. Dokument übermittelt werden (non-structured body), | ||
| + | *oder sich aus strukturierten Abschnitten zusammensetzen (structured body). | ||
| + | Das Element <component> enthält dazu entweder ein Element <nonXMLBody> mit dem unstrukturierten Informationen oder <structuredBody> mit Sections (Abschnitten). | ||
| + | {{HL7transclude| cdaab2:NonXML-Body-Section (Template)}} | ||
| + | {{HL7transclude| cdaab2:Anrede-Section (Template)}} | ||
| + | {{HL7transclude| cdaab2:Grund_der_Überweisung-Section_(Template)}} | ||
| + | {{HL7transclude| cdaab2:Anamnese-Section (Template)}} | ||
| + | {{HL7transclude| cdaab2:Impfung-Section (Template)}} | ||
| + | {{HL7transclude| cdaab2:Befund-Section (Template)}} | ||
| + | {{HL7transclude| cdaab2:Diagnose-Section (Template)}} | ||
| + | {{HL7transclude| cdaab2:besondere Hinweise-Section (Template)}} | ||
| + | <!-- | ||
| + | {{HL7transclude| cdaab2:Allergien-Section (Template)}} | ||
| + | {{HL7transclude| cdaab2:Risiken-Section (Template)}} | ||
| + | --> | ||
| + | {{HL7transclude| cdaab2:Medikation-Section (Template)}} | ||
| + | <!-- | ||
| + | {{HL7transclude| cdaab2:Medikation bei Aufnahme-Section (Template)}} | ||
| + | {{HL7transclude| cdaab2:Medikation bei Entlassung-Section (Template)}} | ||
| + | {{HL7transclude| cdaab2:jetzige Medikation-Section (Template)}} | ||
| + | --> | ||
| + | {{HL7transclude| cdaab2:Massnahme-Section (Template)}} | ||
| + | <!-- | ||
| + | {{HL7transclude| cdaab2:Notiz-Section (Template)}} | ||
| + | --> | ||
| + | {{HL7transclude| cdaab2:Epikrise-Section (Template)}} | ||
| + | <!-- | ||
| + | {{HL7transclude| cdaab2:Labordaten-Section (Template)}} | ||
| + | --> | ||
| + | {{HL7transclude| cdaab2:Empfohlene_Maßnahmen (Template)}} | ||
| + | {{HL7transclude| cdaab2:Schlusstext-Section (Template)}} | ||
| + | {{HL7transclude| cdaab2:Anhang-Section (Template)}} | ||
| − | + | =Entry-Level-Templates für den Arztbrief (normativ)= | |
| − | + | {{HL7transclude| cdaab2:Eingebettetes Objekt Entry (Template)}} | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | {{HL7transclude| cdaab2: | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | <!-- | |
| + | Entries (informativ) | ||
| + | --> | ||
| + | =Entry-Level-Templates für den Arztbrief (informativ)= | ||
| + | Die folgenden Entries sind im Entwurf vorhanden bzw. aus früheren Spezifikationen angelegt und werden hier der Vollständigkeit halber zur Information (nicht-normativ) gelistet: | ||
| − | + | *[[cdaab2:ICD-Diagnose Entry (Template)|ICD-Diagnose]] | |
| − | < | + | *[[cdaab2:Medikation-Entry_(Template)|Medikation]] |
| + | *[[cdaab2:Massnahme-Entry (Template)|Massnahme]] | ||
| + | *[[cdaab2:Externe Referenz-Entry_(Template)|Externe Referenz]] | ||
| + | *[[cdaab2:Diagnose-Entries|Diagnose-Entries]] | ||
| + | </div> | ||
| + | <!-- | ||
| + | der Rest | ||
| + | --> | ||
| + | {{HL7transclude| cdaab2:Umsetzungsstufen}} | ||
| + | {{HL7transclude| cdaab2:Terminologien}} | ||
| + | {{HL7transclude| cdaab2:Anhang}} | ||
| + | {{HL7transclude| cdaab2:Storyboard}} | ||
| + | {{HL7transclude| cdaab2:Anamnesekategorien}} | ||
| + | {{HL7transclude| cdaab2:Beispiel}} | ||
| + | {{HL7transclude| cdaab2:Literatur_und_Referenzen}} | ||
Aktuelle Version vom 4. Februar 2017, 10:54 Uhr
|
|
Dieses Dokument gibt wieder:
Implementierungsleitfaden Arztbrief 2014/2015 (1.00). Die Teilmaterialien gehören der Kategorie cdaab2 an. |
auf Basis der HL7 Clinical Document Architecture Release 2
für das deutsche Gesundheitswesen
HL7 Deutschland
| Version: | 1.00 |
| Datum: | 15. Oktober 2015 |
| Status: | |
| Verfahren: | {{{Verfahren}}} |
| Realm: |
| Abstimmungsdokument | |||
|---|---|---|---|
| Version | Datum | Status | Realm |
| 0.91 | 15.10.2014 | ||
| [download] | |||
| 0.99 | 15.07.2015 | ||
| [download] | |||
| 1.00 | 15.10.2015 | ||
| [download] | |||
| Kontributoren | ||
|---|---|---|
| Agfa HealthCare GmbH | Bonn | |
| Heitmann Consulting & Services GmbH | Hürth | |
| brightOne GmbH (bis Dezember 2013) | Köln | |
| Siemens Healthcare | Erlangen | |

|
ZTG GmbH | Bochum |
Inhaltsverzeichnis
- 1 Dokumenteninformationen
- 2 Einleitung
- 3 Grundlagen
- 4 CDA Release 2 – Konzept und Modellbeschreibung
- 5 Transportaspekte
- 6 Rechtssichere Übertragung
- 7 Struktureller Aufbau
- 7.1 Grober XML-Aufbau von CDA-Dokumenten
- 7.2 CDA R2 Header
- 7.3 CDA R2 Body
- 7.3.1 Allgemeiner Aufbau des Body
- 7.3.2 Levels
- 7.3.3 Textstrukturierung
- 7.4 Datentypen
- 7.5 Identifikationen
- 8 Templates für den Arztbrief
- 9 Dokument-Level-Template für den Arztbrief
- 10 Header-Level-Templates für den Arztbrief
- 10.1 Patient (recordTarget - generisch)
- 10.2 Autor (author - generisch)
- 10.3 Autor (author - Person)
- 10.4 Verwaltende Organisation (custodian - generisch)
- 10.5 Participant: Empfänger (informationRecipient)
- 10.6 Unterzeichner gesetzlich verantwortlich (legalAuthenticator - generisch)
- 10.7 Unterzeichner (authenticator - generisch)
- 10.8 Participant: Datentypist (dataEnterer)
- 10.9 Participant: Informant (informant)
- 10.10 Weitere Beteiligte
- 10.11 Einweisender Arzt
- 10.12 Hausarzt
- 10.13 Notfallkontakt
- 10.14 Angehörige (Template)
- 10.15 Versicherter/Versicherung
- 10.16 Patientenkontakt (EncompassingEncounter - generisch)
- 11 Section-Level-Templates für den Arztbrief
- 11.1 Section: Non-XML-Body
- 11.2 Section: Anrede
- 11.3 Section: Grund der Überweisung
- 11.4 Section: Anamnesen
- 11.5 Section: Verabreichte Impfungen
- 11.6 Section: Erhobene Befunde
- 11.7 Section: Diagnosen
- 11.8 Section: Allergien, Unverträglichkeiten, Risiken
- 11.9 Section: Medikationen
- 11.10 Section: Prozeduren und Maßnahmen
- 11.11 Section: Epikrise (Zusammenfassung des Aufenthalts)
- 11.12 Section: Weitere empfohlene Maßnahmen
- 11.13 Section: Abschließende Bemerkungen (Schlusstext)
- 11.14 Section: Anhang (Beilagen)
- 12 Entry-Level-Templates für den Arztbrief (normativ)
- 13 Entry-Level-Templates für den Arztbrief (informativ)
- 14 Umsetzungsstufen der Aktenkommunikation
- 14.1 Umsetzungsstufe 1: Austausch proprietärer Dokumente
- 14.2 Umsetzungsstufe 2: Austausch CDA Level 1(a) Dokumente
- 14.3 Umsetzungsstufe 3: Austausch CDA Level 1(b) Dokumente
- 14.4 Umsetzungsstufe 4: Austausch CDA Level 2 Dokumente
- 14.5 Umsetzungsstufe 5: Austausch CDA Level 3 Dokumente
- 14.6 Zusammenstellung von Informationen in CDA-Dokumenten
- 15 Terminologien
- 16 Anhang
- 17 Beispiele von Gesamtdokumenten
- 18 Schemas, Schematronregeln
- 19 Zur Darstellung - das neue Stylesheet
- 20 Literatur und Referenzen
Dokumenteninformationen
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Impressum
Dieser Leitfaden ist im Rahmen des Interoperabilitätsforums und den Technischen Komitees von HL7 Deutschland e. V. sowie der entsprechenden Projektgruppen zusammengestellt und unterliegt dem Abstimmungsverfahren des Interoperabilitätsforums[1] und der Technischen Komitees von HL7 Deutschland e. V. [2]
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Ansprechpartner
- Dr. Kai U. Heitmann, HL7 Deutschland e.V., Heitmann Consulting and Services
- Dr. Frank Oemig, Agfa HealthCare GmbH, Bonn
- Mathias Aschhoff, ZTG GmbH, Bochum
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Disclaimer
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Autoren
- Dr. Kai U. Heitmann (KH), Heitmann Consulting and Services, Hürth
- Dr. Frank Oemig (FO), Agfa HealthCare GmbH, Bonn
- Daniel Hellmuth (DH), Cerner Deutschland GmbH, Berlin
- Mathias Aschhoff (MA), ZTG Gmbh, Bochum
Mit Beiträgen von
- Jürgen Brandstätter, HL7 Austria
- Dr. Rainer Fehling, Kassenärztliche Vereinigung Westfalen-Lippe
- Dr. Erich Gehlen, DURIA e.G.
- Dr. Christof Gessner, gematik
- Dr. Christian Herrmann, KRH Klinikum Region Hannover
- Michael Hofer, iSOFT Health GmbH
- Tarik Idris, InterComponentWare AG
- Dr. Stefan Sabutsch, HL7 Austria
- Dr. Norbert Sigmond, DIMDI
- Prof. Dr. Martin Staemmler, FH-Stralsund
- Prof. Dr. Sylvia Thun, HS Niederrhein
- Lars Treinat, ZTG GmbH
Copyright-Hinweis, Nutzungshinweise
Die erste Version dieses Dokumentes wurde 2005 vom Verband der Hersteller von IT für das Gesundheitswesen (VHitG, heute bvitg) entwickelt und ist unter dem Namen "VhitG-Arztbrief" bekannt. Die Nachnutzungs- bzw. Veröffentlichungsansprüche sind nicht beschränkt.
Der Inhalt dieser Spezifikation ist öffentlich.
Der VHitG-Arztbrief basiert auf den Spezifikationen der Arbeitsgemeinschaft SCIPHOX GbR mbH und dem national adaptierten HL7-Standard der „Clinical Document Architecture (CDA)".
Die hier erarbeitete Fassung ist die Weiterentwicklung davon. Sie ist u.a. auch abgeglichen mit den ELGA-Spezifikationen (http://elga.gov.at) in Österreich.
Näheres unter http://www.hl7.de und http://www.hl7.org. Für alle veröffentlichten Dateien mit einem CDA-Bezug gilt ferner: Alle abgestimmten und veröffentlichten Spezifikationen wie Implementierungsleitfäden, Stylesheets und Beispieldateien sind frei verfügbar und unterliegen keinerlei Einschränkungen, da die Autoren auf alle Rechte, die sich aus der Urheberschaft der Dokumente ableiten lassen, verzichten.
Alle auf nationale Verhältnisse angepassten und veröffentlichten CDA-Schemas können ohne Lizenz- und Nutzungsgebühren in jeder Art von Anwendungssoftware verwendet werden.
Aus der Nutzung ergibt sich kein weiter gehender Anspruch gegenüber dem VHitG bzw. bvitg, zum Beispiel eine Haftung bei etwaigen Schäden, die aus dem Gebrauch der Spezifikationen bzw. der zur Verfügung gestellten Dateien entstehen.
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Danksagung
Wir danken besonders den folgenden Organisationen und Projekten.
Bundesverband der Hersteller von IT-Lösungen für das Gesundheitswesen, e.V. , Berlin
eBPG-Projekt (electronic Business Plattform im Gesundheitswesen), NRW
Konsortialprojekt eBusiness-Plattform Gesundheitswesen (Förderkennzeichen 005-GW01-038C)
Arbeitspaket AP04: Einrichtungsübergreifende elektronische Patientenakte (eEPA)
Gefördert von der EU und dem Land NRW:
Deutscher Hausärzteverband e.V., Köln
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Einleitung
Motivation
Dieser Leitfaden soll als generische Grundlage für Arztbriefe aller Art dienen und damit die Ablösung der papiergebundenen Arztbriefe ermöglichen. Entsprechende Anwendungsbeispiele finden sich im Anhang dieses Leitfadens und dienten als Grundlage für die Vollständigkeit der Analyse.
Im Rahmen der Kommunikation zwischen Akteuren im Gesundheitswesen ist der Arztbrief als „Kondensat ärztlichen Handelns" von überragender Bedeutung. Das Ziel dieses Dokuments ist die Beschreibung des elektronischen Arztbriefs. Ein derartiger Arztbrief enthält die medizinisch relevanten Teile der Geschichte eines Patienten über einen bestimmten Zeitraum und ist gedacht zur Übermittlung zwischen Gesundheitsdienstleistern (primär: „Leistungserbringer"). Die Beschreibung enthält Festlegungen, Einschränkungen und Bedingungen auf Grundlage von HL7 CDA-Elementen.
Zielgruppe
Der Leserkreis dieses Dokuments sind Software-Entwickler und Berater, die allgemein mit Implementierungen und Integrationen im Umfeld des „Arztbriefs" betraut sind.
Diese Spezifikation definiert zusätzliche Festlegungen, Einschränkungen und Bedingungen für die CDA-Elemente in „Arztbrief"-Dokumenten, die als „stationärer Entlassbrief" von Kliniken im Bereich deutscher Gesetzgebung (SGB) an Niedergelassene (auch: REHA-Einrichtungen) oder als „(Fach ) Arztbrief" vom niedergelassenen (Fach )Arzt an niedergelassene Kollegen oder Krankenhäuser versendet werden sollen.
Beispiele für konforme Dokumenten-Fragmente werden innerhalb dieses Leitfadens aufgeführt. Die Spezifikation von Infrastrukturen, Workflows, Nachrichten, Prozeduren oder Protokollen zur Übermittlung der Arztbriefe ist nicht im Fokus dieses Dokuments.
Ein elektronischer Arztbrief wird vom Gesetzgeber nach §291a ff. SGB V im Rahmen der Einführung der elektronischen Gesundheitskarte als freiwillige Anwendung betrachtet. Es ergeben sich mit Einführung einer nationalen Telematikinfrastruktur verschiedene Vorgaben für einen solchen Arztbrief, die in diesem Implementierleitfaden nicht umfänglich dokumentiert sein sollen. An den nötigen Stellen wird versucht, Hinweise auf relevante Implikationen und Überschneidungen zu geben.
Dokumente im Gesundheitswesen
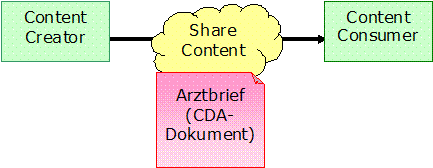
Wir sind es in der medizinischen Welt gewohnt, eine Dokumentenansicht von medizinischen Beobachtungen zu verfassen, reich an Text, den Zusammenhang des Geschehens zusammenstellend und zusammenfassend. Dieser Kontext – z. B. das Ergebnis einer Laboruntersuchung im Lichte einer speziellen Medikamentenbehandlung – muss dauerhaft erhalten bleiben, da er wichtige medizinische Zusammenhänge zwischen Einzelinformationen darstellt. Die Krönung dieses „in den Kontext stellen" von Informationen über die Zeit stellt zum Beispiel der Arztbrief dar. Gleichzeitig muss der medizinische Inhalt leicht verfügbar sein und ohne große technische Barrieren sichtbar gemacht werden können. Dies ist unabdingbar für die Akzeptanz von und das Vertrauen in Technologie bei den Benutzern, den Ärzten und Pflegekräften. Mit der heutigen Papierwelt wurde dies bis zu einem gewissen Grade erreicht, es muss aber für das Einführen des elektronischen Gegenstücks ebenso gelten. „Interoperabilität" ist unter anderem gekennzeichnet durch gemeinsam verstandene Definitionen, wie zum Beispiel die des Patienten und der zu ihm bekannten (klinischen/medizinischen) Informationen, sowie deren Wiederverwendbarkeit. Hierbei kann man zwei Gegenpole beobachten. Zum einen ist da die Facette der Mensch-zu-Mensch Kommunikation. Dies wird z. B. erreicht durch das Versenden von Papier und Formularen. Jeder weiter führende elektronische Ansatz muss auch diese Art der Interoperabilität gewährleisten. Die Möglichkeit zur Signatur muss auch in elektronischer Form bestehen bleiben. Darüber hinausgehend wäre das andere Ende die Anwendungs-Interoperabilität. Dies beinhaltet die Wiederverwendbarkeit von Informationen, Kontext-abhängige Analysemöglichkeiten und angemessenes Speichern und Verwalten von klinischen Dokumenten.
Im Rahmen der bvitg-Initiative „Intersektorale Kommunikation" wird der Arztbrief als generisches Dokument beschrieben. So wird beispielhaft die Entlassung nach durchgeführter Behandlung in einem Krankenhaus o. ä. zur Weiterbehandlung durch den Niedergelassenen (Dokument „stationärer Entlassungsbrief") definiert, wie auch der ambulante Arztbrief des Facharztes zur Weiterbehandlung über den Hausarzt oder im Krankenhaus.
Im Falle der Entlassung/Ende der Behandlung werden die Behandlungsdaten übermittelt. Der Kurzbericht bei Entlassung/Behandlungsende ist als sofortige Mitteilung an den einweisenden/überweisenden Arzt am Ende der Konsultation/Krankenhausaufenthaltes konzipiert und beinhaltet neben der Patientenidentifikation einen Kurzbericht zusammen mit Diagnosen und Therapien, Befunden sowie eine Zusammenfassung. Beispiel: Termine zur Wiedervorstellung oder Nachsorgetermine.
In einer späteren Ausbaustufe kann mit überwiegend den gleichen Teilen wie im Arztbrief auch die Einweisung/Überweisung definiert werden. Das dahinterliegende Szenario: Der Patient geht vom Niedergelassenen in ein Krankenhaus zur Mitbehandlung (Dokument „Einweisung") bzw. wird von einem Niedergelassenen zum anderen überwiesen (Dokument „Überweisung").
Diese Fälle werden allgemein teilweise von den Komponenten im „Arztbrief" abgedeckt, wie zum Beispiel: Aktuelle Medikation, die auch in Ein-/Überweisungen vorkommen kann. Beim Arztbrief handelt es sich dementsprechend um ein Dokument, das in Anlehnung an die realen Gegebenheiten zwischen den Akteuren und Systemen ausgetauscht wird und das dauerhaft existiert, d.h. es wird dauerhaft gespeichert. Dies steht im Gegensatz zum Austausch von Nachrichten, bei dem der Nachrichten-Inhalt vom Empfangssystem in der Regel extrahiert, in der eigenen Datenbank gespeichert und die Nachricht als solche danach gelöscht wird.
Abgrenzung
Dieser Leitfaden deckt eine Reihe von Themen nicht ab. Dazu gehören:
- dieser Leitfaden beschreibt den Arztbrief (Discharge summarization note [physician], LOINC-Code 11490-0); andere Dokumententypen wie z. B. OP-Berichte sind hiermit nicht beschrieben (aber dem Prinzip nach gleich aufgebaut).
- digitale Signatur und andere Sicherheitsaspekte wie Verschlüsselung etc.; der geneigte Leser möge hierzu auch die Ausarbeitung zu XML-Signaturen für CDA (Elektronische Signatur von Arztbriefen)[3] konsultieren.
- Transport von CDA-Dokumenten
- Verwendung von Stylesheets
Hilfreich ist in diesem Zusammenhang das IHE-Cookbook[4].
Aufbau dieses Implementierungsleitfadens
Die Spezifikation Arztbrief 2014 basiert auf dem VHitG-Arztbrief von 2006 (v1.5)[5] und berücksichtigt hierbei die neueren Entwicklungen und Methodiken zur Erstellung von Leitfäden, beispielsweise die Nutzung von Templates oder speziellen Ausprägungen von Datentypen.
Dieser Implementierungsleitfaden verfolgt drei Ziele. Neben dem grundlegenden Konzept und dessen Begründung sollen die zugrunde liegenden Modelle ausführlich beschrieben werden, die für die Kommunikation genutzt werden. Aus ihnen leiten sich die Nachrichten/Dokumente in ihrem Aufbau und ihrer Semantik ab. Gleichzeitig können die Modelle Hinweise liefern für den Aufbau von Datenbanken oder Anwendungssystemen, die in diesem Kommunikationsszenario als Sender oder Empfänger fungieren.
Zum dritten soll dieser Leitfaden praktische Implementierungshilfen geben. Dies kann bis zu einem gewissen Detaillierungsgrad geschehen und ist in der Regel mit Beispielen angereichert, so dass ein Programmierer einer Schnittstelle das nötige Wissen erlangen kann, wie die Schnittstelle aufzubauen ist. Auf dieser Basis werden schließlich die tatsächlichen Informationsinhalte beschrieben und die Beziehung an die entsprechenden Klassen und Attribute im Modell aufgezeigt. Daraus folgen dann Dokumente und zugehörige Beispiele.
Zudem sind in diesem Leitfaden einige Anhänge aufgenommen, die als Referenzmaterial dienen können und Hinweise geben für eine erfolgreiche Implementierung.
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Grundlagen
HL7 Version 3 Referenz-Modell als Grundlage für CDA
Grundlage des Clinical Document Architecture (CDA) ist ein umfangreiches Objektmodell, das sogenannte Reference Information Model (RIM).
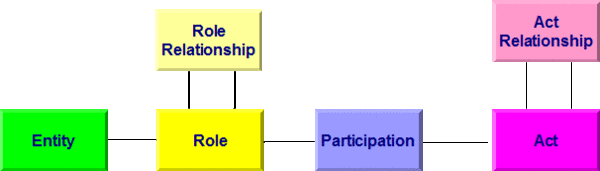
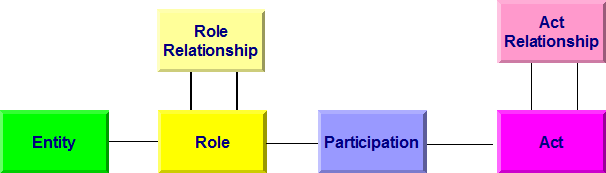
Allen Modellen bei HL7 Version 3 liegt das so genannte Referenz-Informations-Modell (RIM) zugrunde. Es beschreibt generisch zum Beispiel einen Behandlungsprozess. Dabei wird von einer Aktivität (Act) ausgegangen, an der Entitäten (z. B. Personen) in bestimmten Rollen (Arzt, Patient, Angehöriger) teilnehmen (Participation). Aktivitäten können miteinander in Beziehung (Kontext) stehen (Act Relationship), beispielsweise eine Laboranforderung und das daraus folgende Resultat. In der folgenden Abbildung sind die Basisklassen des RIM wiedergegeben. Darunter sind im Gesamt-RIM natürlich noch Spezialisierungen der Klassen zu finden. So ist eine Diagnose ein Sonderfall einer Beobachtung, diese wiederum eine Aktivität.
[Abbildung 1]RIM Basisklassen
Diese Basisklassen erfahren - als Beispiel - folgende Spezialisierungen, die auch in diesem Leitfaden verwendet werden:
- entity
- Person
- Organisation
- Gerät
- role
- beabsichtigter Empfänger
- verwaltende Organisation
- Pate
- ...
- participation
- Patient
- Autor
- Informant
- sonstiger Beteiligter
- Hausarzt
- ...
- act
- Beobachtung
- Diagnose
- Maßnahme
- ..
- Beobachtung
HL7 CDA basiert komplett auf HL7 Version 3, so dass dessen Verständnis hilfreich ist.
Vorgehensweise
Diese Spezifikation basiert auf den umfangreichen Diskussionen innerhalb der Arbeitsgruppe „Intersektorale Kommunikation" und wurde ergänzt durch Einschränkung bzw. Konkretisierung bestehender nationaler und internationaler Implementierungsleitfäden, namentlich
- „Sciphox Arztbrief" (gemäß WD 15)[6]
- HL7 v3 , CDA Rel. 2 „CDA Care Record Summary Implementation Guide"[7]
- Use Cases for Medical Summaries, L. McNight, IHE PCC, 2005[8]
- Der französische „Guide d’implémentation du Volet Médical au format CDA Release 2 – Niveau 3"[9]
- e-MS. Implementierungsleitfaden CDA (Level 2 und 3), Kanada[10]
- IHE Laboratory Technical Framework, Supplement „Sharing Laboratory Reports (XDS-LAB)"[11]
- CDA-Leitfäden der ELGA GmbH, Wien (Österreich)[12]
- CDA-Leitfäden von HL7 Schweiz
und schließlich als Zusatzdokument mit entsprechenden Mechanismen formal festgelegt.
Als Fernziel sei auch der Einsatz von HL7-Tools erwähnt, mit dem derartige Festlegungen auch automatisch aus formalen Ausdrücken der CDA Refined Message Information Model (R-MIM) Constraints abgeleitet werden können. Der dazu benötigte HL7-Template-Formalismus - derzeit noch als Teil von HL7v3 in Entwicklung – wird einen eindeutigen Generierungspfad vom Reference Information Model (RIM) bis zu den Validierungsausdrücken und Constraints festlegen. Damit könnten Schemata algorithmisch aus den modell-bezogenen Templates auf die gleiche Weise generiert werden, wie auch das allgemeine CDA-Schema aus seinem R-MIM generiert wurde.
Die Festlegungen in diesem Dokument werden formal durch XSD-Schemas formuliert. Die Schemas sind originaler CDA Release 2 Standard.
Zertifizierung
Die Verwendung des Implementierungsleitfadens in Softwareprodukten ist grundsätzlich frei von jeglicher Zertifizierung.
Stabilität der verwendeten Standards
Standards in der Medizin, so auch Kommunikationsstandards, entwickeln sich kontinuierlich weiter, um den ständig ändernden Anforderungen gerecht zu werden. Allerdings ist eine kontinuierliche Weiterentwicklung in Bezug auf reale Implementierungen nicht handhabbar.
Deshalb wählt man zu einem gegebenen Zeitpunkt, im Sinne einer Momentaufnahme, die zu verwendenden Standards aus und „friert" diesen für eine Zeit lang ein. Das heißt für diesen Leitfaden, dass in Bezug auf die verwendeten Standards stabile Verhältnisse für etwa zwei Jahre zu erwarten sind.
HL7 konstatiert zudem die Möglichkeit, dass Versionen, die zum Beispiel auf unterschiedlichen Implementation Technology Specifications (ITS) beruhen, durch „einfache" Transformationen (z. B. mittels XSLT) ineinander überführbar sind.
CDA Release 2 (CDA R2) ist ANSI Standard seit Mai 2005. Dieser Leitfaden fußt auf ANSI/HL7 CDA R2-2005, derweil gehen die Entwicklungen bei CDA weiter, So ist derzeit (Sommer 2014) das Release 2.1 in Vorbereitung, eine verbesserte und leicht ergänzte Version von CDA R2. Viele (insbesondere internationale) Spezifikationen basieren auf CDA (zum Beispiel IHE PCC, ELGA, CDA-CH2). Implementierungen (so auch die auf diesem Leitfaden basierten) liefern kontinuierlich Verbesserungsvorschläge. So wurde in diesem Leitfaden auch intensiv Gebrauch vom Templatemechanismus gemacht, welcher insbesondere Entwicklern zugute kommt. In Summa kann festgehalten werden, dass damit CDA R2 der erfolgreichste HL7 Version 3 Standard ist.
Die verwendeten Datentypen sind mit den Festlegungen in „XML Implementation Technology Specification - Data Types Release 1" schon länger ANSI Standard (seit der Jahreswende 2004/05). Diese sind auch im Leitfaden "HL7 Version 3 Datentypen und CMETs Leitfaden für das Deutsche Gesundheitswesen" veröffentlicht.
Bezug zum HL7 Version 3 Nachrichtenaustausch
Das CDA-Informationsmodell stellt eine Beschreibung für die Nutzinhalte von medizinischen Dokumenten zur Verfügung. Dabei wird aber explizit kein Hinweis auf den elektronischen Informationsaustausch von CDA-Dokumenten gegeben.
Von Seiten HL7 wird dieses durch die Einbeziehung in das Nachrichtenkonzept von HL7 Version 3 vollzogen, insbesondere die abstrakten Transmission Informationen (Wrapper-Konstrukte) und weitere Infrastrukturelemente (u. a. Control Acts).
Damit ist eine Use-Case abhängige Koexistenz von medizinischen Dokumenten und Nachrichten-Konzepten sowie konkrete Einbindbarkeit von CDA in Nachrichtenabläufe gegeben. Dies stellt aus HL7-Sicht einen wichtigen Eckpfeiler für einen effizienten Austauschstandard im Gesundheitswesen dar.
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
CDA Release 2 – Konzept und Modellbeschreibung
CDA und XML
Für XML als grundsätzliches Format spricht die Flexibilität nicht nur bei der Länge einzelner darzustellender Texte sondern auch bezüglich der a priori nicht begrenzten Schachtelungstiefe von Elementen.
HL7 als IT-Standard im Gesundheitswesen ist vornehmlich in Krankenhäusern verbreitet und wird zum Datenaustausch zwischen Abteilungssystemen eingesetzt. Der ursprünglich aus Amerika stammende Ansatz ist im Laufe der Zeit zu einem international einsetzbaren Standard geworden, auch dank vieler internationaler Benutzergruppen, die seit langem an der Weiterentwicklung von HL7 mitwirken. Mittlerweile wird HL7 in vielen Ländern konkret eingesetzt, ist in manchen Ländern sogar offizielle Norm. Dennoch wurde HL7 in Deutschland im niedergelassenen Bereich oder in der ambulant-stationären Kommunikation bisher nicht umgesetzt.
Zwischenzeitlich ist von der HL7-Organisation der Standard „HL7 v3" international entwickelt und anerkannt worden (bzw. abhängig von den Anwendungsdomänen noch in Verabschiedung und Anerkennung). HL7 v3 bietet:
- eine konzeptuelle Grundlage in einem gemeinsamen, umfassenden „Reference Information Model" (RIM) für alle Teile von HL7 v3; dieses RIM ist ANSI- und ISO-Standard
- ein festes semantisches Fundament in explizit definierten Konzept-Domänen
- ausgewählte standardisierte Terminologien, die in den Domänen semantische Interoperabilität garantieren
- die Trennung von Inhalten und Syntax (wenngleich die Verwendung bestimmter Elementnamen vor allem im Header eine gewisse Semantik suggerieren)
- eine technologie-unabhängige Entwurfsmethodik.
HL7 v3 basiert auf XML und wird genutzt für die Übermittlung von Nachrichten. HL7 stellt außerdem einen Standard zur Strukturierung, zum Inhalt und zum Austausch medizinischer Dokumente, der so genannten Clinical Document Architecture (CDA), zur Verfügung. Dabei steht der Informationsaustausch im gesamten Gesundheitswesen im Vordergrund, ist also nicht beschränkt auf Krankenhäuser. Als Grundlage für die Dokumente wurde HL7 Version 3 CDA Release 2 gewählt.
CDA Standard
Die Clinical Document Architecture[13] ist ein Standard für den Austausch und die Speicherung von klinischer Dokumentation, wie zum Beispiel ein Entlassbrief oder eine Überweisung, Behandlungsdokumentation oder OP-Berichte. Dabei wird die Extensible Markup Language XML[14] benutzt. CDA wird entwickelt von HL7 (Health Level Seven), einer bedeutenden internationalen Organisation für die Entwicklung von IT-Standards für das Gesundheitswesen.
CDA ist eine Entwicklung innerhalb der HL7-Gruppe seit 1997 und stellt einen XML-basierten Dokumenten-Markup Standard zur strukturierten klinischen Dokumentation zur Verfügung. Es definiert ein Informationsobjekt, das außerhalb einer Nachricht existieren kann und neben (strukturiertem) Text auch Bilder, Töne, Biosignale usw. enthalten bzw. referenzieren kann. CDA ist Teil der so genannten „Familie" der HL7 Version 3 Standards. Die erste Version, CDA Release 1, konnte bereits im September 2000 als offizieller Standard verabschiedet werden (CDA Level One ANSI/HL7 CDA R1.0-2000). Damit galt CDA R1 als erster offizieller XML-basierter Standard im Gesundheitswesen. Mittlerweile wird Release 1 in unzähligen Projekten rund um die Welt genutzt. Auf zwei internationalen Konferenzen 2002 und 2004 wurden die verschiedenen Projekte dargestellt (siehe Proceedings[15] [16]). Die Erfahrungen und weiter gehende Bedürfnisse sind in die Entwicklung von CDA Release 2 eingegangen.
CDA Release 2 als Fortentwicklung dieses Standards wurde, nach beinahe fünf Jahren weiterer Entwicklungsarbeit am Standard, im Juli 2005 zum ANSI Standard erhoben. In diese Entwicklungen sind zahlreiche Erfahrungen aus weltweit mehr als 15 größeren, teilweise nationenweiten Projekten eingeflossen, die sich intensiv um CDA Release 1 und der Weiterentwicklung verdient gemacht haben. Basierend auf dem HL7 Referenz-Informationsmodell (siehe oben) besteht CDA Release 2, grob gesprochen, aus Tags/Markup, die Semantik bereitstellen für Personen und Dokumenteneigenschaften (z. B. <patient>, <provider>, <authenticator>, etc.) und für die Abbildung von Dokumentenstrukturen und -hierarchien genutzt werden können (z. B. <section>, <paragraph>, <table>, etc.).
Der Name für dieses Konzept änderte sich – aus der ursprünglichen Kona-Architektur wurde die Patient Record Architecture und dann schließlich die Clinical Document Architecture – aber die Ideen dieser Architektur sind gleich geblieben.
Ein wichtiges Konzept in CDA ist das der Level, die a.a.O. weiter erläutert werden (siehe unten in diesem Leitfaden).
Eigenschaften von CDA Dokumenten
Im Standard werden sechs Kerneigenschaften definiert, die ein klinisches Dokument nach CDA kennzeichnen. Diese seien hier im Folgenden eingehender erläutert.
Persistenz
CDA Dokumente sind Persistenz, das heißt dauerhaft Existent in den sendenden oder empfangenden Systemen. Dies kennt man auch aus der Papierwelt (klinische Dokumentation hat „Dokumenten-Charakter").
Verantwortlichkeit für die Verwaltung des Dokuments
Eine Organisation ist verantwortlich für die Verwaltung eines CDA Dokuments.
Signaturfähigkeit
Ein CDA Dokument ist durch Informationen gekennzeichnet, die potentiell signiert werden können bzw. zur vor dem Gesetz gültigen Signatur benutzt werden können. (vgl. [3])
Kontext
Alle Informationen werden in Dokumenten in einen bestimmten Kontext gestellt. Ein Entlassbrief fasst z. B. alle Informationen der vorangegangenen Behandlungsepisode im Kontext der Entlassung zusammen. Diese Kontextbewahrung gilt für das ganze Dokument.
Ganzheit des Dokuments
Der Inhalt eines klinischen Dokuments bezieht sich immer auf das Dokument als Ganzes, Teilinformationen daraus können nicht ohne Bezug auf das Dokument verwendet werden.
Lesbarkeit (human readability)
Jedes CDA Dokument muss die klinischen Informationen in lesbarer Form enthalten. Diese Lesbarkeit der klinischen Inhalte für die menschlichen Kommunikationspartner ist dadurch gewährleistet, dass man diesen Anteil im XML Dokument mit sehr einfachen Mitteln (z. B. so genannte Stylesheets) sichtbar machen kann. Dies betrifft sowohl den CDA-Body als auch die strukturierten Informationen im CDA-Header. Dafür gilt zudem:
- Es muss einen deterministischen Weg für einen Empfänger geben, den authentifizierten Inhalt sichtbar, sprich für lesbar zu machen.
- Die Lesbarkeit sollte nicht beinhalten, dass ein bestimmtes Stylesheet zusammen mit dem CDA Dokument gesendet werden muss. Es muss möglich sein, den Inhalt mit einem geeigneten Stylesheet und marktüblichen Browsern darzustellen.
- Lesbarkeit bezieht sich auf den authentifizierten Inhalt. Zusätzlich kann weitere Information im Dokument vorhanden sein, die auf Auswertbarkeit durch Anwendungssysteme abzielt, die aber nicht lesbar dargestellt werden muss.
- Wenn strukturierter Inhalt vom narrativen Text abgeleitet ist, muss der Mechanismus beschrieben sein, wie dies bewerkstelligt wurde, z. B. durch den Autor, durch eine Person, die die Codes hinzugefügt hat, durch automatisierte Verarbeitung der natürliche Sprache, durch eine spezifische Software.
- Wenn narrativer Text von strukturierter Information abgeleitet ist, muss der Mechanismus beschrieben sein, wie dies bewerkstelligt wurde.
CDA Modellbeschreibung
Wie alle Spezifikationen von Nachrichten in HL7 basiert auch die Clinical Document Architecture auf dem RIM und ist als HL7 V3 Modell repräsentiert.
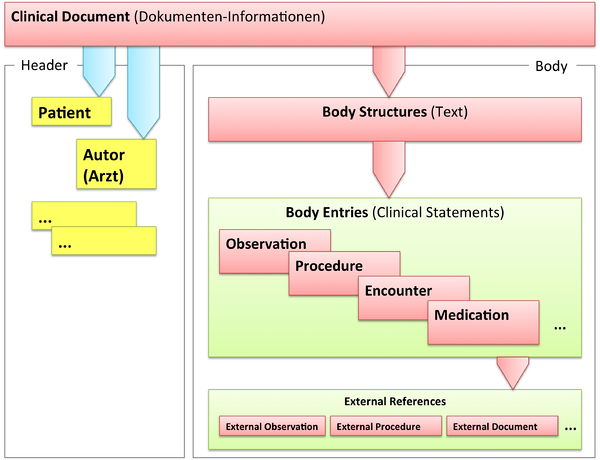
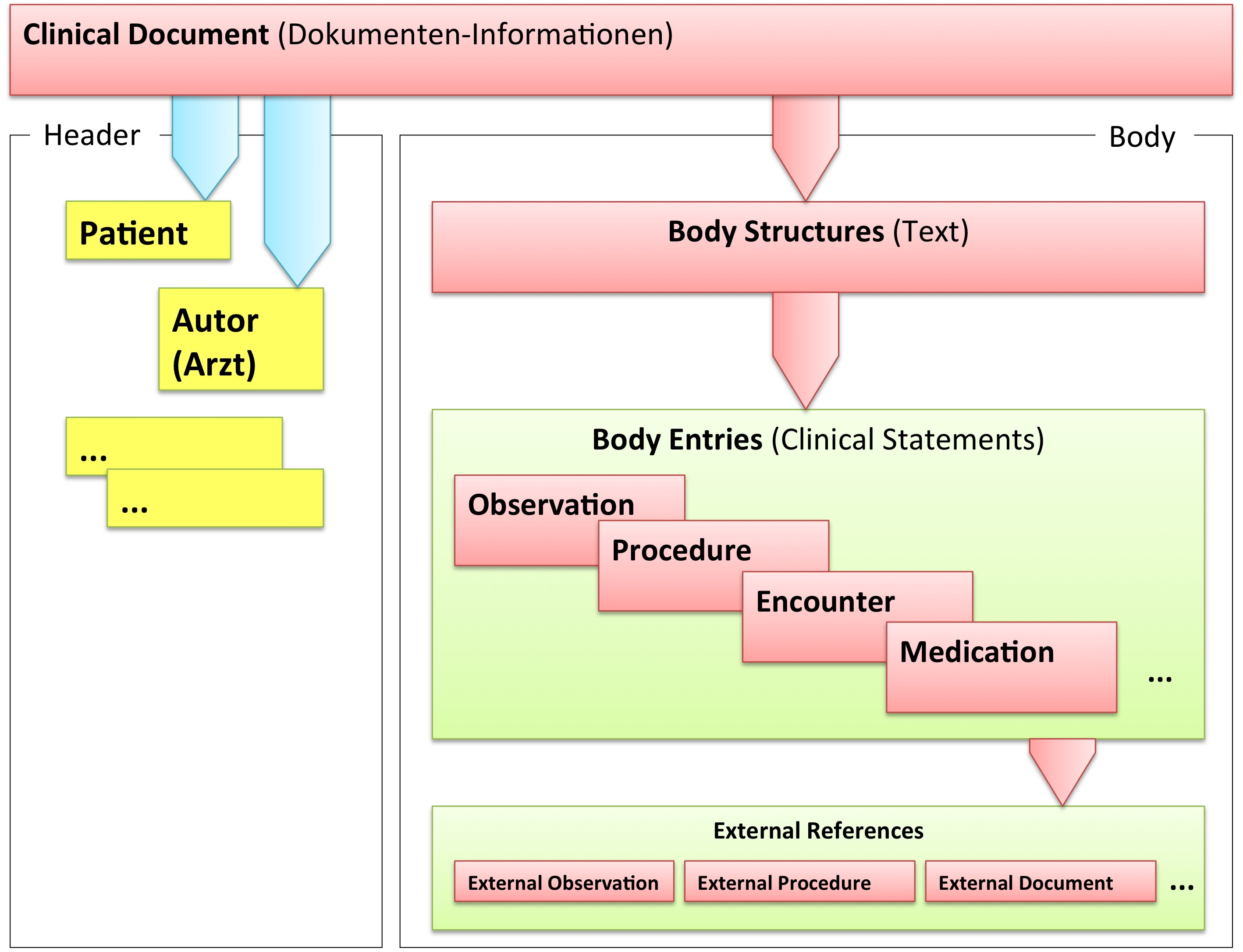
Grob gesprochen besteht ein CDA Dokument aus einem Header und einem Body, der wiederum Body Structures und CDA Entries aufweist. An die Entries können externe Referenzen (External References) geknüpft sein. Der folgende Überblick zeigt die Hauptkomponenten des CDA R2 Modells auf, in der Abbildung 3 ist das Ganze in XML-artiger Darstellung gezeigt.
[Abbildung 2] Vereinfachte Übersicht über einen Teil des CDA Modells mit Clinical Document Header (Informationen über das Dokument sowie deren Beteiligte, einschließlich Patient), Body Structures (Abschnitte und narrativer Text), CDA Entries (maschinenauswertbare Detailinformationen). Schließlich können auch externe Referenzen aufgeführt sein.
[Abbildung 3] Grober Aufbau eines CDA Dokuments aus XML Sicht.
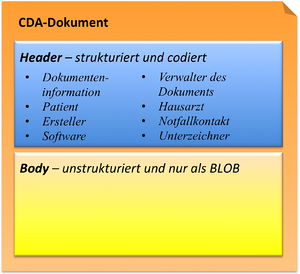
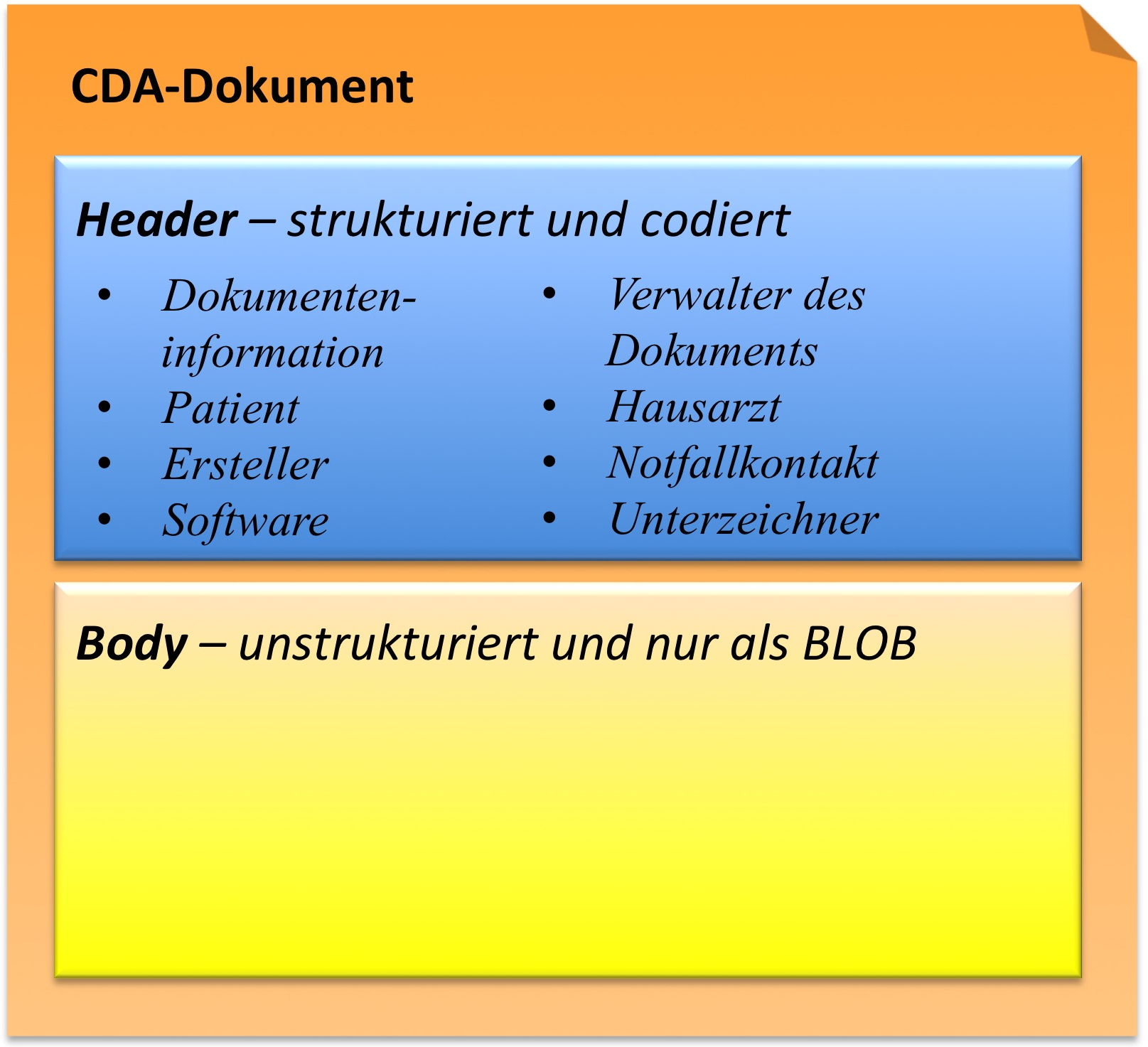
CDA Header
Die Informationen zum Patienten, zum Dokument selbst, zu den weiteren beteiligten Personen und Organisationen sowie der dokumentierten Episode (Zeitereignisse) sind zum CDA Header zusammengefasst, hochstrukturiert und von der Semantik her festgelegt.
Die Informationen im Header unterstützen einen Austausch klinischer Dokumente über Institutionsgrenzen hinweg. Er trägt Informationen über das Dokument selbst (eine eineindeutige Identifikation, der Typ des Dokuments), über „Teilnehmer" am Dokument (an der Dokumentation beteiligte Heilberufler, Autoren, und natürlich den Patienten selbst), sowie über Beziehungen zu Dokumenten (zu Anforderungen und anderen Dokumenten). Mit den Informationen des Headers werden Dokumentenmanagement-Systeme unterstützt, der Header stellt dafür entsprechende Metadaten zur Verfügung. Schließlich hat man mit den im CDA Header verfügbaren Informationen die Zusammenführung einer individuellen (lebenslangen) Patientenakte vor Augen.
CDA Body
Die eigentliche klinische Dokumentation wird im so genannten CDA Body festgehalten. Im Vordergrund steht hier „lesbarer" (narrativer) Text, der verpflichtender Bestandteil von CDA R2 Dokumenten ist und die Interoperabilität zwischen den menschlichen Kommunikationspartnern garantiert.
Hier sind Möglichkeiten gegeben, diesen Text grob zu strukturieren, wie man dies von den Möglichkeiten der Textverarbeitung her kennt. Zur Strukturierung stellt die Standardspezifikation eine Reihe von XML-Elementen zur Verfügung, die als Body Structures zusammengefasst werden können. Der Body enthält ein oder mehrere Abschnitte (sections). Diese können auch ineinander geschachtelt sein, so wie Kapitel und Unterkapitel in einem Buch. Zudem sind Strukturierungen im Sinne von Tabellen oder Listen möglich.
- Abschnitte <section>
- Paragrafen <paragraph>
- Kennzeichnung von bestimmten Inhalten <content>
- Überschriften <caption>
- Tabellen <table>
- Listen <list>
Sections enthalten immer einen narrativen Block und erfüllen damit eine der oben genannten Maximen von CDA: die Mensch-zu-Mensch-Interoperabilität, die Lesbarkeit der Informationen für den Menschen. Im narrativen Block, durch das Textattribut in der section-Klasse repräsentiert, wird eingebetteter Text innerhalb eines Abschnittes angegeben. Dabei kann mit oben genanntem <content> Element bestimmter Inhalt gesondert gekennzeichnet werden. Zusammengefasst werden im Textblock (teils so auch schon in CDA Release 1 realisiert) u.a. folgende Möglichkeiten der Struktur- und Formgebung des fließenden Textes gegeben:
- Zeilenumbrüche
- Stilistische Angaben (unterstreichen, fett, kursiv etc.)
- Hoch- und Tiefstellung von Text
- Fußnoten
- Symbole
- Revisionsmarken im Text wie <delete>, <insert>
Mit den beschriebenen Body Strukturen können CDA Entries verbunden sein. Diese repräsentieren den „computerlesbaren Teil" innerhalb eines Dokumentenabschnitts. CDA Entries sind im Prinzip eine Auswahl aus Klassen mitsamt Attributen aus dem HL7 Referenz-Informationsmodell (RIM). In der folgenden Abbildung ist ein Ausschnitt daraus gezeigt.
[Abbildung 4] Ausschnitt aus der Auswahlliste der CDA Body Entries mit Darstellung der HL7 RIM-Klassen und deren Attributen
Diese Auswahlliste von Aktivitäten wird auch als Clinical Statement Pattern bezeichnet und findet sich in gleicher oder ähnlicher Form auch in HL7-Version 3-Nachrichten zu Anforderungen und Befunden etc. wieder. Eine konkrete Ausprägung davon wird dann als Clinical Statement bezeichnet. In dieser Auswahl sind folgende Klassen verfügbar:
- observation, eine (kodierte) Beobachtung, z. B. ein Befund oder eine Diagnose
- procedure, eine Prozedur, z. B. eine Operation, eine andere Behandlung, rein diagnostischer Eingriff
- encounter, Angaben zu früheren, jetzigen oder geplanten Patientenkontakten
- substanceAdministration, medikamenten-bezogene Angaben im Sinne von stattgefundenen (Medikamentenanamnese) oder geplanten Medikamentengaben
- supply, zur Verfügungstellung von Material oder Medikamentenverabreichungen
- organizer, zur Gruppierung von anderen CDA Entries (Batterien, Cluster)
- observationMedia, multimedialer Inhalt als Teil des Dokuments
- regionOfInterest, Kennzeichnung einer Hervorhebung eines Teilaspekts eines Bildes.
Alle diese Entries können untereinander linear oder rekursiv hierarchisch verbunden sein. Es sind gleichstufige Beziehungen möglich (zum Beispiel eine Liste von Beobachtungen), aber auch die Wiedergabe einer Hierarchie (z. B. „kleines Blutbild", bestehend aus „Erythrozyten", „Leukozyten",...).
Die folgende Abbildung zeigt das ganz CDA Release 2 Modell.
[Abbildung 5] Clinical Document Architecture Release 2.0
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Konzept der Templates
Wie aus den vorhergehenden Erläuterungen ersichtlich ist, setzt sich ein Dokument aus verschiedenen Komponenten zusammen, die flexibel miteinander kombiniert werden können. Für ein Zusammensetzen der Einzelteile auf den unterschiedlichen Ebenen gibt es detaillierte „Baupläne“, die in CDA auch Templates – oder Schablonen oder auch Muster – genannt werden.
Es werden die folgenden Template-Typen bei CDA unterscheiden.
Document Level Template
Angabe der benötigten Einzelteile für eine bestimmte Art von Dokument. So legt die Schablone für einen Arztbrief beispielsweise fest, dass ein Arzt das Dokument für einen anderen Arzt erstellt und somit sowohl eine Anrede und eine Grußformel enthalten sollte. Bei einem einfachen Meldebogen ist letzteres nicht der Fall.
Inhalt: Festlegung des Inhalts des Dokuments inklusive der Header und Section-Level-Templates sowie weiterer Header-Metadaten
Header Level Template
Angabe, wie die größeren Blöcke im Header eines Dokumentes konkret aussehen sollen, zum Beispiel welche Details zu einem Patienten hinterlegt werden können. Beispiele für Inhalt: Patient, Autor, Unterzeichner, weitere Beteiligte, ..
Section Level Template
Inhalt: Angabe, wie ein bestimmter Abschnitt konkret aussehen soll. Hier können auch Vorgaben gemacht werden, wie zum Beispiel Diagnosen in einer tabellarischen Form textuell aufbereitet werden sollen, damit sie einheitlich durch ein Stylesheet zur Anzeige gebracht werden können. Möglicherweise existieren passende Entry-Level-Templates zu der Sektion. Hier kann auf die optionale oder verpflichtende Nutzung von Entry-Level-Templates hingewiesen werden.
Beispiele für Inhalt: Anrede, Diagnose, Maßnahme, ..
Entry Level Template
Angabe, wie die Einzelinformationen in struktierter und kodierter Form hinterlegt werden sollen, damit sie durch ein Programm ausgewertet und weiter verarbeitet werden können.
Beispiele für Inhalt: ICD-Diagnosen, Maßnahmen, Scores und Assessments, Meldeanlässe, ..
Datentypen
Hier handelt es sich genau genommen nicht um Templates, sondern um sog. „Datentypen-Flavors“, jedoch beschreiben diese wie ein Datentyp in einem bestimmten Use Case genutzt werden soll. So kann es beispielsweise zwei unterschiedliche Ausprägungen für Adressen geben, die vollständige Adresse lässt Straßennamen oder Postfächer zu, der Geburtsort wird auf die Stadt inklusive Land eingeschränkt. Diese Datentypen werden in den drei vorher genannten Arten von Templates genutzt.
Inhalt: Verwendung bei Namen, Adressen, Telefonnummern, ..
Profile Components
Templates stellen somit sog. „Profile Components“ dar, sind also selber konkrete Ausprägungen allgemeiner Vorgaben für einen bestimmten Use Case. Derartige Ausprägungen können hierarchisch vorgenommen werden. Nachfolgend sei das an einem Beispiel erläutert.
| Stufe | Hierarchie / ID | Inhalt | Einschränkung |
|---|---|---|---|
| 1 | Author (HL7 International) 2.16.840.1.113883.10.12.102 |
Originäre Spezifikation aus dem CDA-Header | Keine |
| 2 | Author allgemein (HL7 Deutschland) 1.2.276.0.76.10.2002 |
Ausdifferenzierung inklusiver aller Details | Anwendung von Datentypen-Flavors |
| 3 | Author Person (HL7 Deutschland) 1.2.276.0.76.10.2007 |
Reduzierung auf eine Person als Autor | Streichung der Auswahlmöglichkeit |
| 3 | Author Gerät (HL7 Deutschland) 1.2.276.0.76.10.2008 |
Reduzierung auf ein Gerät als Autor | Streichung der Auswahlmöglichkeit |
[Tabelle 1] Beispiel für eine Template-Hierarchie
Eine weitere wichtige Eigenschaft ist die Feststellung, ob Templates „offen“ oder „geschlossen“ sind, d.h. ob nur die definierten Elemente zugelassen sind (geschlossen) oder ob auch Erweiterungen – gemäß dem zugrunde liegenden Modell – erlaubt sind (offen). Hier gibt es unterschiedliche Vorgehensweisen. So macht es für die Angaben im Header durchaus Sinn, alle notwendigen Details soweit vorzugeben, so dass in Spezialisierungen bei nicht benötigten Attributen/Klassen nur die entsprechenden Auswahlmöglichkeiten gestrichen werden müssen, während für die Angaben im Body nur bedingt möglich ist, alle Eventualitäten vorzugeben.
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
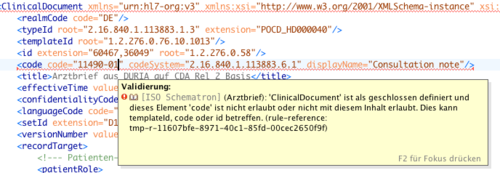
Konformität
Ein zu diesem Implementierungsleitfaden (engl. Implementation Guide) konformer Arztbrief ist zunächst ein valides CDA Release 2 XML-Dokument mit Header und Body. Ein konformer "stationärer Entlassbrief" kann weiterhin fehlerfrei gegen das CDA Schema (xsd) validiert werden und erfüllt außerdem alle „Geschäftsregeln" im weiteren Text dieses Dokuments.
Dies spiegelt ein generelles Konzept im Umgang mit Dokumenten (und Nachrichten) wieder: die Validierung in zwei Schritten. Im ersten Schritt stellt dies die Validierung gegen zugehörige W3C Schemas dar. Das zum Arztbrief gehörige Schema ist das unveränderte generische, offizielle CDA Release 2 Schema (siehe Anhang). Darüber hinaus sind eine Reihe von Schematron Skripts denkbar (und im Rahmen dieses Leitfadens auch erstellt), die für einen zweiten „Validierungsschritt" genutzt werden und letztlich die Detailregelungen in diesem Leitfaden wiedergeben sowie die Einhaltung der Geschäftsregeln sicherstellen können. Diese Schritte werden auch als Templates bezeichnet, allgemeine Arbeiten zu diesem Thema sind zurzeit in Gange, jedoch noch nicht abgeschlossen, so dass wir hier auf bewährte Techniken (W3C Schema und Schematron) zurückgreifen. Eine XML-Instanz, die kein valides CDA-Dokument ist oder sich nicht gegen das XSD-Schema validieren lässt, oder im Widerspruch zu den angegebenen Geschäftsregeln steht, ist kein gültiger Arztbrief im Sinne dieses Implementierungsleitfadens.
Die hier verwendeten Constraints basieren zum Teil auf extern kontrollierten Vokabularen, die sich nach Verabschiedung dieses Implementierungsleitfadens ändern könnten.
CDA ermöglicht die Identifikation der verwendeten Templates mithilfe eines eindeutigen Identifikators. Der Einsatz von so genannten „templateId" Elementen sichert zu, dass eine CDA-Instanz nicht nur CDA-konform ist, sondern auch dem referenzierten Template oder Implementierungsleitfaden entspricht. Mit Zusicherung ist dabei nur eine informelle Behauptung des Verfassers gemeint und nicht notwendigerweise auch eine erfolgreich durchgeführte Validierung bzw. Zertifizierung.
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Kardinalität und Konformität von Elementen
Für die einzelnen Datenelemente wird über die Spalte Card die Kardinalität und in Conf. die Konformität vorgegeben. Die verwendeten Symbole haben folgende Bedeutung:
| Conf. | Bedeutung | Erklärung | Kardinalität |
|---|---|---|---|
| M | Mandatory | Das Element muss mit einem gültigen Wert gefüllt sein. Null-Flavors sind nicht zugelassen. | mindestens 1x oder häufiger |
| R | Required | Das Element muss unterstützt werden. | 0x oder häufiger |
| O | Optional | Es steht frei, dieses Element zu unterstützen. | 0x oder häufiger |
| NP | Not Permitted | Das Element muss leer bleiben. | 0 |
[Tabelle 2] Optionalität von Elementen
Es wird empfohlen, die zugrunde liegende HL7 Version 3 Dokumentation zu Rate zu ziehen.
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Transportaspekte
Interaktionsdiagramm
In diesem Leitfaden geht es um die Präzisierung des Aufbaus von Dokumenten (hier: der Arztbrief), d.h. wie diese inhaltlich strukturiert sind. Die Prinzipien der Gliederung gelten aber auch für andere Arten von Dokumenten wie Ein-/Überweisungen, Befunde, etc.
Im Allgemeinen wird ein CDA-Dokument von einer Anwendung in einem bestimmten Kontext erzeugt und dann als ganzheitliches Objekt übertragen. Dies kann auf unterschiedlichen Wegen passieren (bspw. als Datei, als Binärobjekt in einer Email oder als Objekt einer Akte wie EFA, eEPA oder EGA), diese werden hier aber nicht spezifiziert. Dieses Objekt wird dann letztendlich von einer – oder mehreren – Anwendungen konsumiert:
[Abbildung 6] Interaktionsdiagramm
Dokumentenaustausch
Für den Austausch der Dokumente gibt es mehrere Möglichkeiten, zu denen eine Reihe von konkreten Vorgaben existieren - insbesondere bei IHE ITI -, die hier nur kurz genannt werden sollen:
- IHE ITI
- die Integrationsprofile XDS, XDM und XDR
- Telematikinfrastruktur (in Vorbereitung) mit KOM-LE
- KV-Connect
- Safemail
- FTP
- ...
Diese Liste ist nicht vollständig und soll nur als Beispiel dienen.
Rechtssichere Übertragung
Eine eAU kann papierbegleitend, aber auch papierersetzend umgesetzt werden. Im letzteren Fall ist diese mit einer rechtssicheren elektronischen Signatur (fortgeschritten oder QES) zu ergänzen:
- Datenschutz-/-sicherheit
- IT-Sicherheit
- Verschlüsselung
- Signaturen
|
|
Diese Aspekte Datenschutz/-sicherheit, IT-Sicherheit, Verschlüsselung und Signaturen sind nicht Bestandteil dieser Spezifikation. Es gibt dazu aber bereits entsprechende Ausarbeitungen und Vorgaben. |
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Struktureller Aufbau
Das statische Modell umfasst
- Die zentrale Klasse ClinicalDocument und den Header mit einer Reihe von assozierten Header-Klassen (Patient, Autor, Empfänger, etc.) und
- den CDA-Body mit Section und Entries.
Grober XML-Aufbau von CDA-Dokumenten
Der XML-Namespace für CDA Release 2 Dokumente ist urn:hl7-org:v3 (Default-Namespace). Dieser muss in geeigneter Weise in jeder XML Instanz genannt werden. In diesem Leitfaden werden typischerweise keine namespace-Präfixe (z. B. "hl7:" oder "cda:") genutzt (Verwendung von default namespace), die Ausgaben der Templates aus ART-DECOR verwenden das Präfix "hl7:".
Für die Arztbrief XML-Dokumente auf der Basis von CDA Release 2 ist der Zeichensatz UTF-8 vorgeschrieben. Arztbrief XML-Dokumente beginnen mit dem Wurzelelement ClinicalDocument, der grobe Aufbau ist im folgenden Übersichtsbeispiel gegeben.
<?xml version="1.0"? encoding="UTF-8">
<ClinicalDocument
xmlns="urn:hl7-org:v3"
xmlns:xsi="http://www.w3.org/2001/XMLSchema-instance">
<typeId root="2.16.840.1.113883.1.3" extension="POCD_HD000040"/>
<!-- CDA Header -->
… siehe Beschreibung CDA R2 Header
<!-- CDA Body -->
<component>
<structuredBody>
… siehe Beschreibung CDA R2 Body
</structuredBody>
</component>
</ClinicalDocument>
|
|
Das Dokument muss mit dem Element <ClinicalDocument> beginnen und die in obiger Abbildung genannten xmlns: Deklarationen aufweisen. |
CDA R2 Header
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
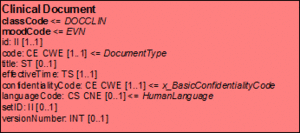
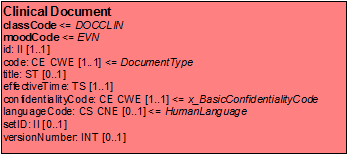
Clinical-Document Klasse
ClinicalDocument ist die zentrale Klasse des Clinical Document Architecture Modells. Die zugehörigen CDA-Header-Elemente und deren Bedeutung, so wie sie in den im Anhang beschriebenen Anwendungsszenarien zur Anwendung kommen, werden im Abschnitt zur Dokumentenstruktur und beim Dokumenten-Level-Template in diesem Leitfaden detailliert beschrieben.
[Abbildung 7]Clinical Document Klasse
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
CDA-Header-Assoziationen
Der Header umfasst neben bereits aufgelisteten einfachen Metadaten noch folgende Beziehungen, diese sind hier der Übersicht halber aufgelistet. Die Verwendung im Arztbrief wird unter Arztbriefstruktur aufgelistet und deren genauen Details später noch genauer spezifiziert.
| CDA-Header-Assoziationen | |
|---|---|
| Element (Sequenz) | Bedeutung |
| Participations | |
| recordTarget | Patient |
| author | Autor / Urheber |
| dataEnterer | Datentypist |
| informant | Informant |
| custodian | verwaltende Organisation |
| informationRecipient | Empfänger |
| legalAuthenticator | vor dem Gesetz verantwortlicher Unterzeichner |
| authenticator | weitere Unterzeichner |
| participant | Beteiligte |
| Act Relationships | |
| inFulfillmentOf | In Erfüllung von, –noch nicht verwendet– |
| documentationOf | Dokumentierte Gesundheitsdienstleistung, –noch nicht verwendet– |
| relatedDocument | Bezug zu vorhergehenden Dokumenten |
| authorization | Einverständniserklärung |
| componentOf | Informationen zum Patientenkontakt |
[Tabelle 3] CDA-Header-Assoziationen
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
CDA R2 Body
Allgemeiner Aufbau des Body
Während im CDA Header die Akteure und mehr oder weniger administrative Inhalte wie Informationen über das Dokument selbst, den Patienten, den Autor etc. festgelegt wurden, enthält der CDA Body des hier definierten Arztbriefes die eigentliche klinische Dokumentation und stellt den „menschenlesbaren" medizinischen Teil dar.
Der hier definierte Arztbrief besteht im Body entweder aus einem nonXMLBody oder einem structuredBody Element, das wiederum section Elemente aufweist, mit denen die Information strukturiert werden kann. Falls nur die Metainformationen (Header) strukturiert übertragen werden und der Body nur aus einem Dokument (z. B. PDF) besteht, sollte man nonXMLBody verwenden (CDA Level1), das Dokumente entweder referenziert oder eingebettet wiedergeben.
Danach zeichnet sich für den Arztbrief folgende Grobstruktur ab.
Variante 1 - unstrukturierter Body
<ClinicalDocument>
<!-- CDA Header -->
... siehe Beschreibung CDA R2 Header
<!-- CDA Body -->
<component>
<nonXMLBody>
<text mediaType="application/pdf" representation="B64">
sadsfFAETQETEdfgStreTdsfgSrgregWRTERtSFGwERtwtergq45ttGw5TW%TwtR%TG
vbnbnDJDZwrGTarGFaerewFasFaGaERgGtRzRthsYDFfGeRTertwerfFgERT3$RT34r
dfE$R%34ReFD34T34TG§$t§4%T3ER§4t5§4TWEWRt§$t5§$t§g§$rt§$tGF$§t§$t$t
...
cwER"§$wer§$65$%gTGH5643FD§$KJDU21%ZuTz$%z3vXCvSDf2EQeGFE§rwFG3$T%$
e545REG34T%$gtrfgeg=
</text>
<languageCode code="de-DE"/>
</nonXMLBody>
</component>
</ClinicalDocument>
Variante 2 - strukturierter Body
<ClinicalDocument>
<!-- CDA Header -->
... siehe Beschreibung CDA R2 Header
<!-- CDA Body -->
<component>
<structuredBody>
... CDA R2 Body
</structuredBody>
</component>
</ClinicalDocument>
nonXMLBody (Variante 1)
Wie bereits angedeutet gibt es die Möglichkeit, lediglich den Header zur Übermittlung von strukturierten Metadaten zu einem Arztbrief zu nutzen:
[Abbildung 8] CDA nonXMLBody
Bei dieser Variante wird der Inhalt als Ganzes übermittelt. In diesem Fall besteht der Body lediglich aus einer verkürzten XML-Struktur, in der das Dokument eingebettet ist. Dann kann es allerdings nicht weiterverarbeitet und nur zur Anzeige mit einem geeigneten Viewer gebracht werden. In diesem Fall kommt ausschließlich die nonXMLBody-Section zum Einsatz.
structuredBody (Variante 2)
In der folgenden Grafik ist wiedergegeben, dass der CDA Body für den Arztbrief aus ein bis vielen Abschnitten (section) besteht. Diese können auch ineinander geschachtelt sein, um so – ähnlich wie in einem Buch – Unterabschnitte zu reflektieren. Als Beispiel ist hier ein „Kapitel" Anamnese zu nennen, das sich wiederum untergliedern könnte in „Eigenanamnese", „Familienanamnese", „Sozialanamnese" sowie „bisherige Operationen", „bisherige Impfungen" etc. In der Regel sind die Abschnitte mit Codes versehen (siehe unten). Manche Abschnitte sind mit zusätzlichen Einträgen (Komponenten) versehen, die RIM-Klassen entsprechen und hochstrukturierte Codierungen zulassen.
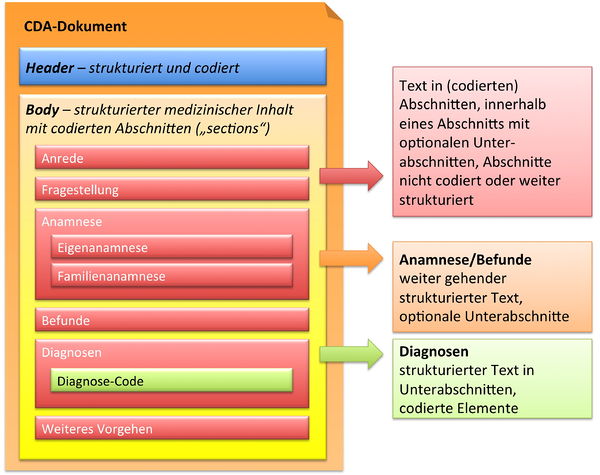
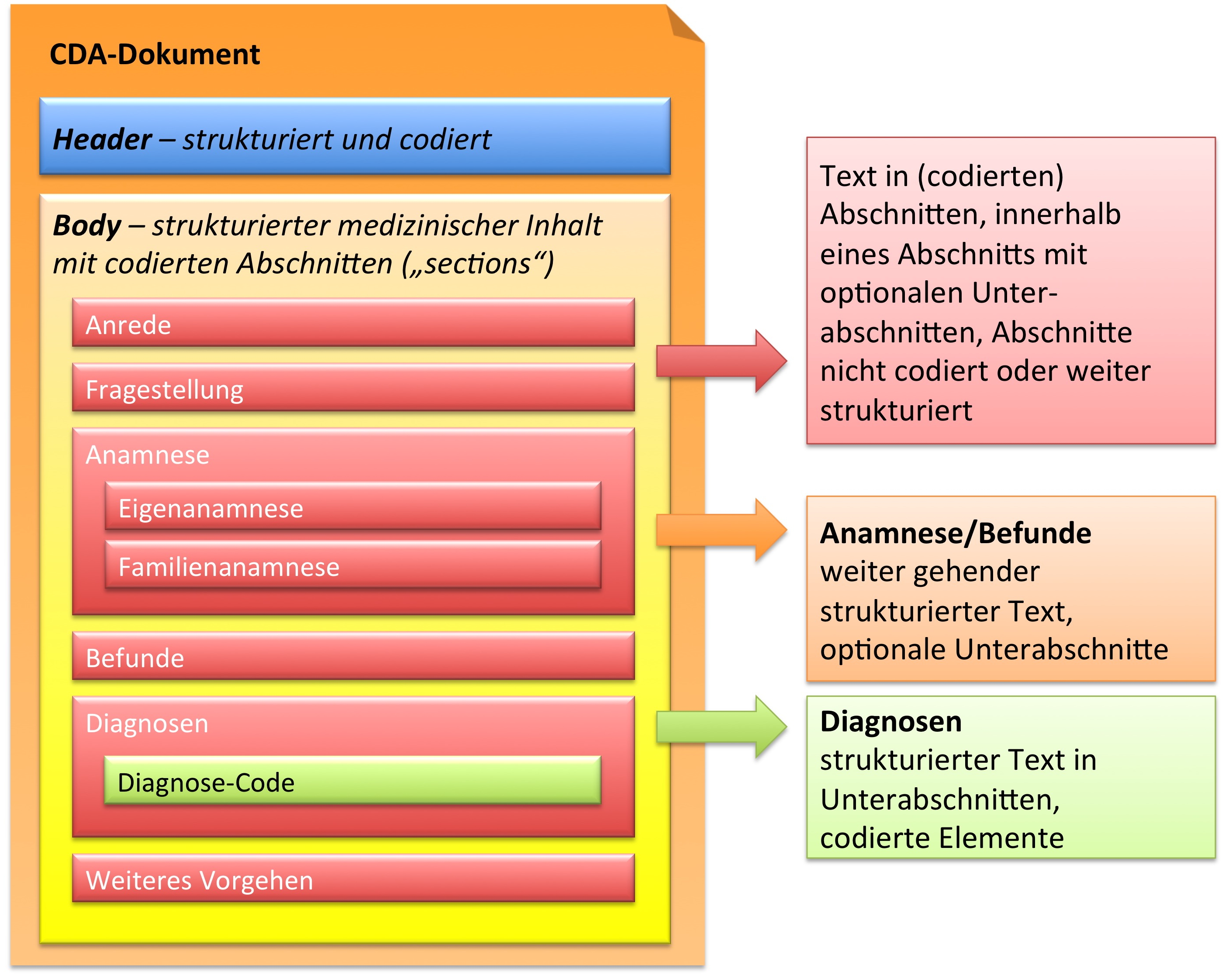
Zusammenfassend sind drei Typen von Abschnitten in der hier vorliegenden Arztbrief-Definition zu finden.
- Text in Abschnitten, die nicht mit Codes identifiziert sind, innerhalb eines Abschnitts mit optionalen Unterabschnitten (Level 1, s. u.)
- Text in Abschnitten, die mit Codes identifiziert sind, innerhalb eines Abschnitts mit optionalen Unterabschnitten (Level 2, s. u.)
- Text in Abschnitten und Unterabschnitten, zusätzlich mit codierten Einträgen, die RIM-Klassen entsprechen (Level 3, s. u.).
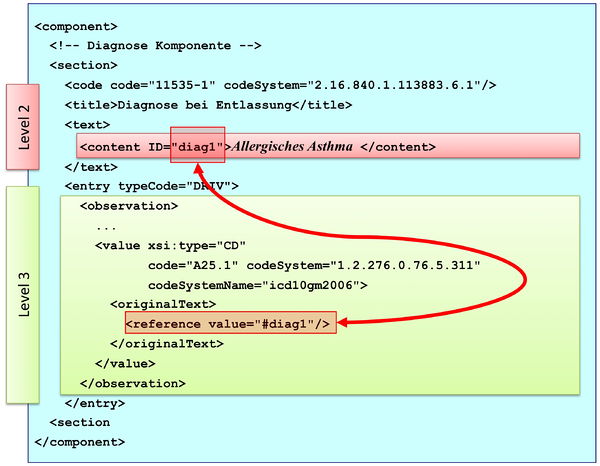
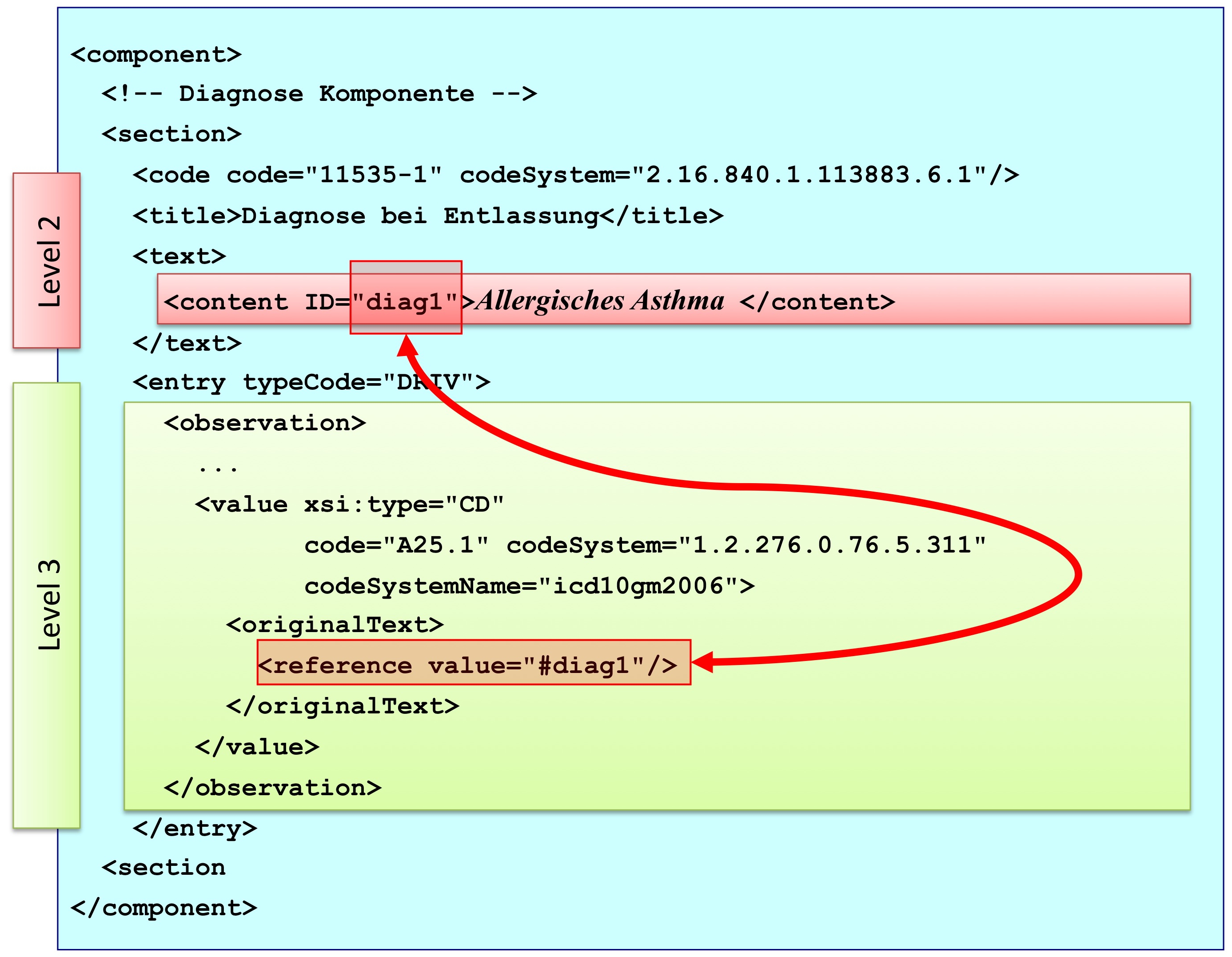
[Abbildung 9] Übersicht über den Body-Teil des CDA-Dokuments. Die medizinische Dokumentation wird als Text in Abschnitten abgelegt, die vorzugsweise mit Codes identifiziert sind. Innerhalb eines Abschnitts kann es optionale Unterabschnitte geben, die eine weiter gehende Strukturierung ermöglichen. Für Diagnosen werden neben codierten Abschnitten auch hochstrukturierte Komponenten vorgesehen, die RIM-Klassen (z. B. Observation) entsprechen. Hier ist als Beispiel der Diagnose-Code für eine Entlass-Diagnose angedeutet.
Der structuredBody eines CDA Release 2 Dokuments setzt sich aus ein oder mehreren Komponenten zusammen, wobei jede Komponente wiederum aus einer oder mehreren Sektionen und gegebenenfalls aus einem oder mehreren „Entry"-Elementen (siehe Abschnitt „Level: 1 bis 3") besteht.
Das bedeutet unter anderem, dass ein CDA-Dokument dahingehend näher bestimmt werden kann, dass es spezifische Abschnitte, Paragrafen und andere Strukturbestandteile aufweisen muss. So kann ein Entlassbrief aus der Urologie beispielsweise ganz bestimmte Abschnitte beinhalten (Anamnese, Behandlung, Medikation, weiteres Vorgehen etc.), während ein OP-Bericht oder ein Pathologie-Befund ganz andere Erfordernisse bezüglich der Abschnitte und Strukturen haben kann bzw. muss.
Attribute von strukturierten Sections
Section.title: Titel des Abschnitts
Das section Element enthält einen optionalen Titel. Näheres regeln die entsprechenden spezialisierten Templates.
Section.text: Text des Abschnitts
Das section Element enthält eine narrative Beschreibung des Inhaltes und ist verpflichtend anzugeben.
|
|
Der Text in den Abschnitten kann mit bestimmten Elementen strukturiert werden, die im Abschnitt Textstrukturierung genauer beschrieben sind. |
Section.code: Klassifizierung des Abschnitts
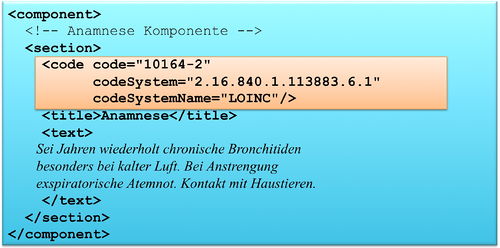
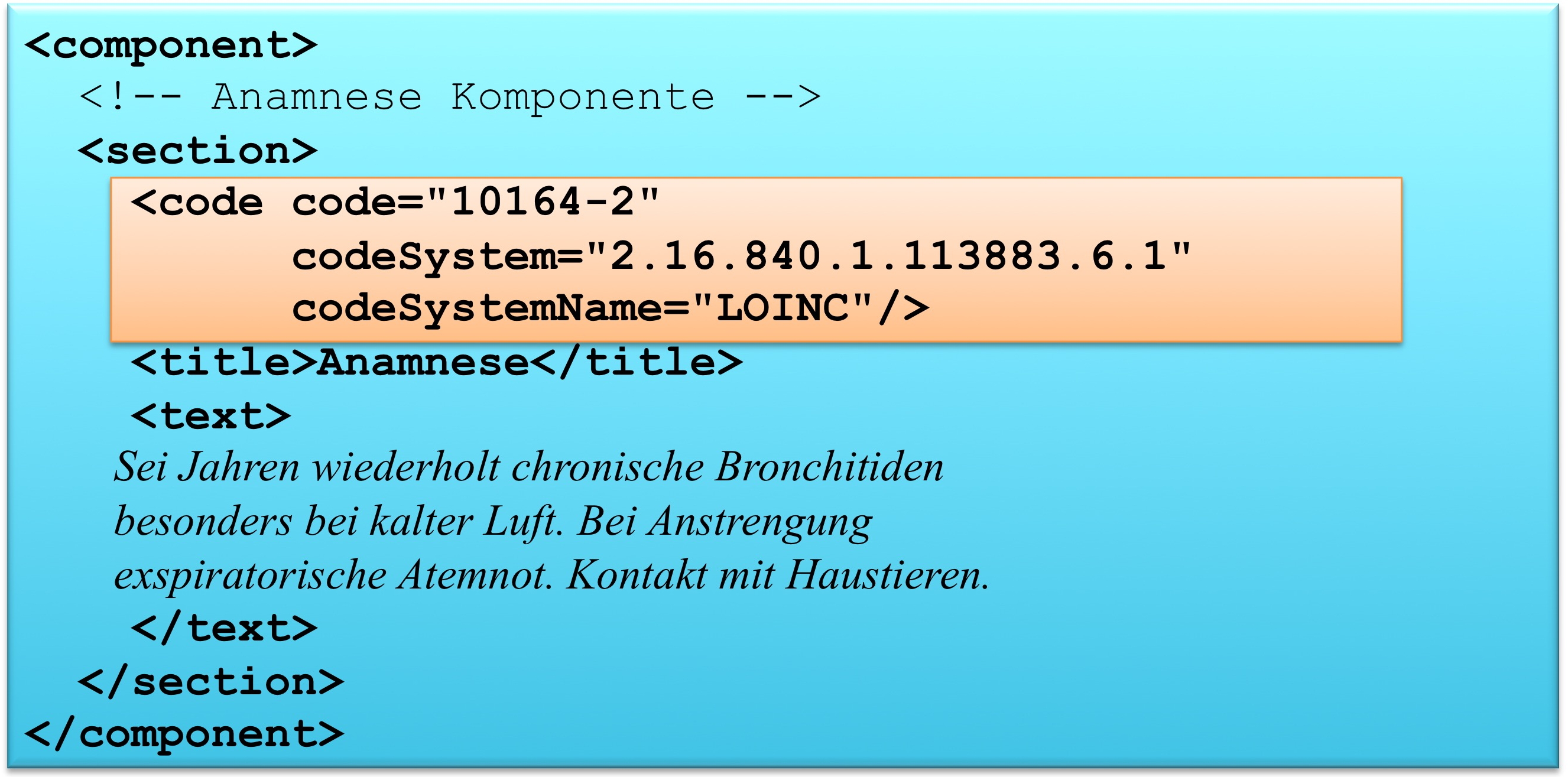
Das section Element kann ein code Element enthalten, das den Inhalt des Abschnitts klassifiziert. Als Beispiel ist 10164-2 der LOINC Code für „History of Present Illness". Im Arztbrief sind zur primären Klassifikation ausschließlich LOINC Codes zugelassen. Alternative Codes können angegeben werden. Näheres regeln die entsprechenden spezialisierten Templates.
Section.languageCode: Sprache des Abschnitts
Jeder Abschnitt kann in einer anderen Sprache geschrieben sein. Dies wird im section-Element languageCode angegeben, wenn diese von der für das ganze Dokument (mittels languageCode im Header) gewählten abweicht. Weitere Informationen finden sich bei der Beschreibung des Elements languageCode des Headers. Hiervon wird allerdings typischerweise selten Gebrauch gemacht.
Beispiele für Abschnitte in einem Dokument
Ein Dokument besteht aus einem oder mehreren Abschnitten, die bei CDA auch Sections genannt werden. Nachfolgend ein paar typische Beispiele:
- Anrede
- Fragestellung
- Anamnese
- Befund
- Diagnosen
- Diagnoseleitfaden
- Diagnose (Sektion)
- ICD-Diagnose (Entry)
- TNM-Klassifikation (Entry)
- besondere Hinweise (CAVE)
- Therapie/Behandlungsmaßnahme
- Notiz
- Epikrise
- Medikation
- Labordaten
- ..
- Schlusstext
- Anhang
Entry
Die Abschnitte/Sections enthalten den Text, der direkt zur Anzeige verwendet werden soll. Für eine Maschine ist dieser normalerweise nicht direkt auswertbar. Dafür ist ein weiterer Mechanismus vorgesehen, bei dem die dem Text zugrundeliegenden Inhalte strukturiert ausgedrückt und in XML dargestellt werden. Diese Zusatzinformationen werden Entries genannt und innerhalb der Abschnitte optional eingebettet.
So kann beispielsweise ein Abschnitt Diagnose mit einer textuellen Darstellung der Diagnose ("Patient hat Blinddarmentzündung") ein Entry Diagnose enthalten, in dem die Diagnose als ICD-Code mit allen dazugehörigen Metadaten dargestellt wird.
Levels
Die CDA Level repräsentieren die unterschiedliche Feinheit (Granularität) der wiedergegebenen klinischen Informationen und des maschinen-auswertbaren Markups (standardisierte Form der maschinenauswertbaren Auszeichnung von Text).
Level 1
Mit Level 1 ist ein XML Dokument gekennzeichnet, das vor allem auf „menschliche Interoperabilität" abzielt („human readable"), also leicht für den menschlichen Gebrauch zugänglich gemacht werden kann, zum Beispiel durch Stylesheets. Es gibt keine Einschränkungen den Gebrauch oder Zweck des Dokuments oder den Inhalt betreffend. Die technischen Anforderungen, Level 1 Dokumente zu erzeugen oder zu verarbeiten, sind verhältnismäßig niedrig. Dies ist aus Datenverarbeitungssicht das gröbste Niveau von Informationen, gewährleistet damit aber sofort die Mensch-Mensch-Interoperabilität, die aus der reinen Papierwelt bekannt ist.
[Abbildung 10] CDA Level 1
Level 2
Im Level 2 wird der Aufbau der Abschnitte genauer festgelegt. Diese Festlegung kann sowohl die textuelle Darstellung mit <text> und <title> Elementen betreffen als auch die Vorgabe, den Abschnitt mit einem bestimmten Code kenntlich zu machen.
Die Identifikation dieser Abschnitte ist dann auch für Applikationen zugänglich, also maschinenauswertbar. Dies wird typischerweise erreicht durch die Assoziation des Abschnitts mit einem Code (oder einem Set von mehreren Codes). Hierfür werden in diesem Leitfaden ausschließlich LOINC Codes zur Dokumentenabschnittsklassifizierung verwendet. Eine andere Möglichkeit der Kenntlichmachung ist die Zuordnung einer Template-Identifikation, von der in dieser Spezifikation auch Gebrauch gemacht wird (siehe unten).
[Abbildung 11] CDA Level 2
Als Folge davon können so genannte section-level Templates zur Anwendung kommen. Mit den Codes sind die Abschnitte auch maschinen-auswertbar, d. h. durch Applikationen identifizierbar. Das bedeutet unter anderem, dass ein CDA Abschnitt dahingehend näher bestimmt werden kann, dass es spezifische Textteile (Paragraphen, Listen, Tabllen, etc.) aufweisen muss. So kann für einen Abschnitt mit Labordaten bspw. genau die Tabellenstruktur vorgegeben werden, d.h. welche Spalten in welcher Reihenfolge zu erscheinen haben.
Es liegt auf der Hand, dass die Spezifikation der Abschnitte eng verbunden ist mit dem Typ des Dokuments, z.B. ein OP-Bericht. In Arztbriefen - wofür dieser Leitfaden entwickelt wurde - macht man hier relativ wenig Vorgaben, während in Formularen oder Berichten relativ genaue Vorgaben zu erwarten sind.
Die häufigste Präzisierung ist die Vorgabe einer Menge von Codes für das Attribut code.
Level 3
CDA-Dokumente, die auch Level 3 konform sind, beinhalten zusätzlich auf dem Niveau von Einzelinformationen maschinen-auswertbare Komponenten (wie beispielsweise „systolischer Blutdruck"), die RIM-Klassen entsprechen. Eine Anwendung kann damit Daten wie eine einzelne Beobachtung, Prozedur, Medikamentengabe etc. identifizieren und verarbeiten. Selbst die Anwesenheit von bestimmten Einzelinformationen kann durch Vorgaben (Templates-Konzept) verpflichtend gemacht werden.
[Abbildung 12] CDA Level 3
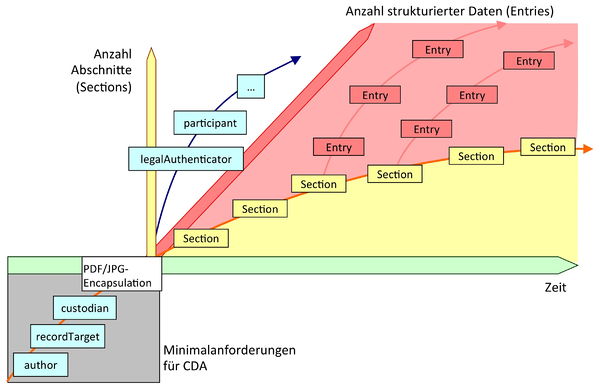
Ingesamt spricht man bei CDA und der hier beschriebenen Architektur der Level von einer „inkrementellen bzw. variablen semantischen Interoperabilität". Das heißt schlicht, dass man sehr „bescheiden" anfangen kann und elektronische Dokumente nutzt, die im Wesentlichen Gegenstücke zum Papier sind: Mensch-Mensch-Interoperabilität. Je mehr eine Anwendung oder eine Anwendungsumgebung ermöglicht, desto mehr XML Markup kann man schrittweise zufügen: zunächst dadurch, bestimmte Abschnitte zu identifizieren oder gar zu fordern (Level 2) oder schließlich auf dem Niveau von Einzelinformationen anzugeben bzw. diese verpflichtend zu machen (Level 3). Dies bedeutet dann Anwendungsinteroperabilität.
Die folgende Grafik gibt eine Section Komponente mit ihren Bestandteilen wieder.
[Abbildung 13] CDA Section Komponente mit ihren Bestandteilen
Abbildung: Eine Abschnittskomponente (section) besteht aus einem <code>, der den Abschnitt typisiert, sowie einer Überschrift im <title>. Im obligatorischen <text> Teil sind die lesbaren Informationen repräsentiert. Dies ist verknüpft mit dem Begriff Level 2. Teile des narrativen Texts können darüber hinaus maschinenauswertbar im Level 3 repräsentiert werden, den so genannten CDA Entries <entry>. Zwischen Teilen des narrativen Texts und den Entries können Verbindungen angegeben werden.
XML-technisch gesprochen validieren CDA-Dokumente unabhängig vom Level gegen das generische CDA Schema. Zusätzlich können durch Festlegung bzw. Einschränkung der Abschnitte oder Detailinformationen weitere Validierungen verfügbar gemacht und genutzt werden.
Mit diesem Konzept ist es möglich,
- narrative Befunde elektronisch strukturiert wiederzugeben, so wie sie heute in der papierbasierten Welt zu finden sind, mit oder ohne zusätzliches Markup. Gleichzeitig wird gewährleistet, dass so viele gemeinsame Informationen wie möglich den Anwendungen zur Verfügung stehen (shared semantics), wie zum Beispiel die Identifikation und andere allgemeine Daten des Patienten.
- feingranulierte und kodierte Informationen darzustellen, wie Diagnosen, Prozeduren, Medikationen etc., die in (ggf. vorgegebenen) Kodierschemas wie ICD 10 repräsentiert sind, sowie Mess- oder Laborergebnisse darzustellen.
- Dokumente abzubilden, die irgendetwas zwischen diesen beiden Extremen von grober Strukturierung von narrativem Text bis zu feingranulären Einzelinformationen repräsentieren.
Man kann dies auch als Möglichkeit ansehen, „sanft" und ohne allzu hohe Ansprüche zu beginnen, elektronische Dokumente einzuführen und mit steigenden Anforderungen und technischen Möglichkeiten zu höherer Anwendungsinteroperabilität zu migrieren.
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Textstrukturierung
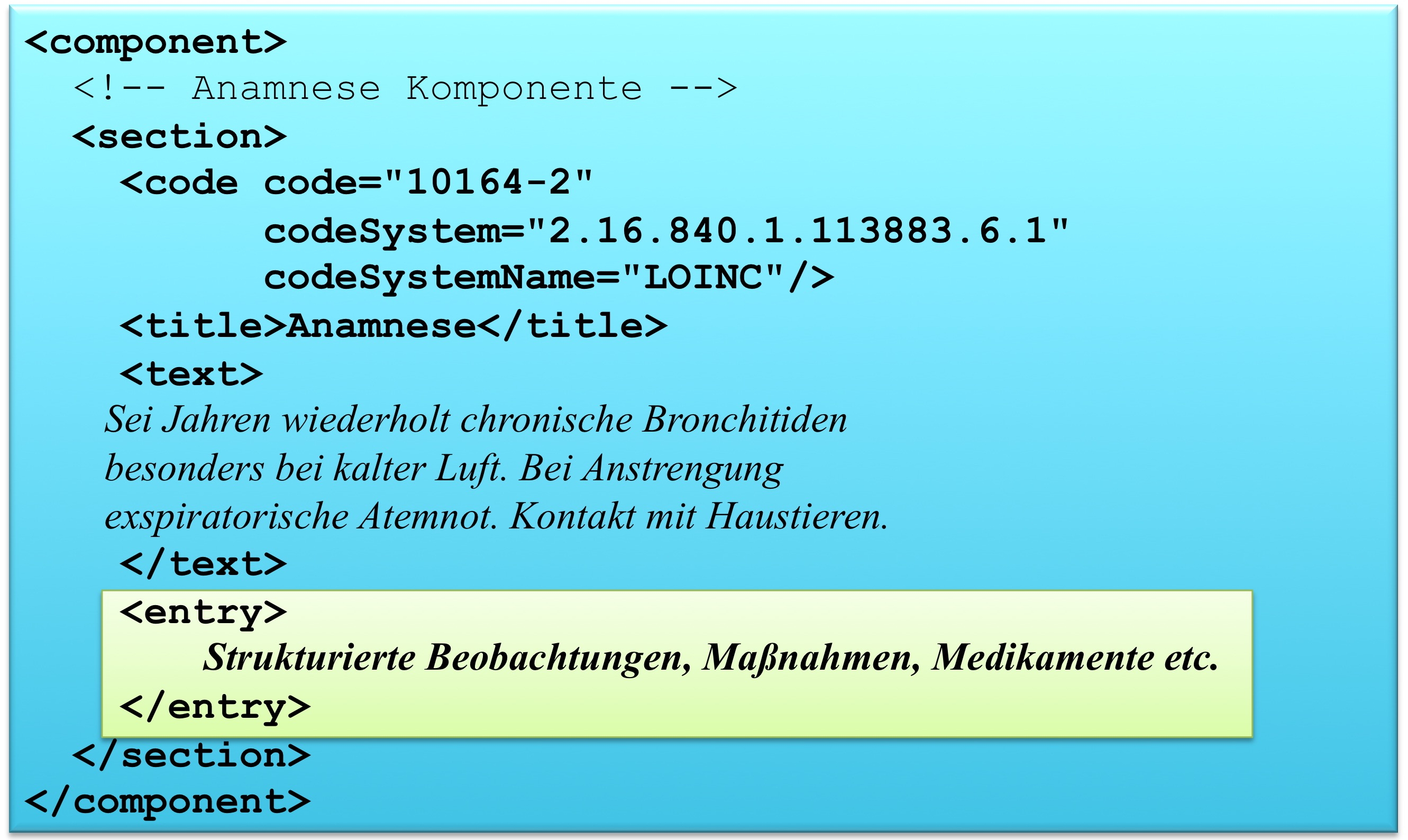
Die medizinischen Informationen werden im CDA Body im Sinne von Level 1 immer in Textform wiedergegeben (verpflichtend) und wo immer möglich auch mit Section-Codes versehen, also auf Level 2 dargestellt. Dies garantiert, dass die Dokumente immer für den Menschen lesbar (und verstehbar) sind. Im Folgenden ist das Muster einer Level 1 und Level 2 Darstellung gezeigt. Level 3 ist angedeutet:
<component>
<structuredBody>
...
<component>
<section>
<!-- Level 2 -->
<code code="..." codeSystem="..." />
<!-- Level 1 -->
<title> ... </title>
<text>
...
</text>
<!-- Level 3 -->
<entry>
...
</entry>
</section>
</component>
...
</structuredBody>
</component>
Textauszeichnung
Der Text selber kann wiederum Strukturelemente aufweisen. Dies kann genutzt werden, um Listen, Tabellen oder auch Unterabschnitte zu definieren. Innerhalb eines Section-Tags wird in CDA Level 2 das text Tag verwendet, um den narrativen Text („plain text") darzustellen. In vielen Fällen lassen sich die medizinischen Inhalte aber auch noch weiter gehend strukturiert darstellen. Dazu stehen in CDA als Stil-Elemente Listen, Tabellen und Unterabschnitte (Paragrafen) zur Verfügung. Mit Hilfe eines einfachen Stylesheets können die Inhalte in diesen Strukturelementen für den Menschen lesbar dargestellt werden.
Listen
Das Strukturelement „Liste" dient zur Abbildung einer einfachen Aufzählung medizinischer Inhalte. Eine Liste wird mit dem list Tag eingeschlossen. Das optionale Attribut @listType ermöglicht die Auflistung unsortiert (@listType="unsorted"), die üblicherweise mit Bulletpoints • dargestellt wird, und in sortierter Form (@listType="sorted") , die mit Zahlen etc. dargestellt wird. Ohne Angabe von @listType ist die Liste unsortiert. Ein Element der Aufzählung (item) wird mit dem item Tag eingeschlossen. Eine Liste hat formal das folgende Aussehen:
<list>
<item> 1. Element der Liste</item>
<item> 2. Element der Liste</item>
<item> ...</item>
<item> n. Element der Liste</item>
</list>
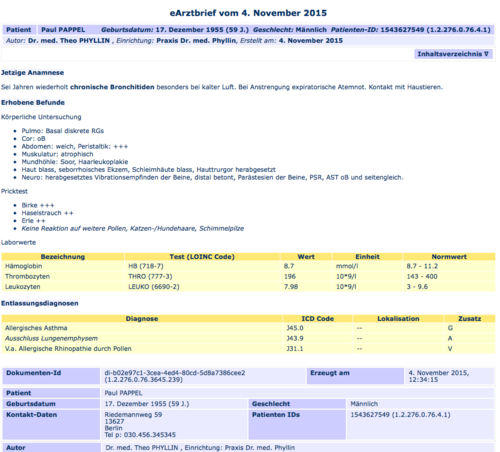
Das folgende Beispiel zeigt eine mögliche Darstellung eines Befundes, strukturiert mittels Liste.
<text>
<list>
<item>Pulmo: Basal diskrete RGs</item>
<item>Cor: oB</item>
<item>Abdomen: weich, Peristaltik: +++</item>
<item>Muskulatur: atrophisch</item>
<item>Mundhöhle: Soor, Haarleukoplakie</item>
<item>Haut blass, seborrhoisches Ekzem, Schleimhäute blass,
Hautturgor herabgesetzt</item>
<item>Neuro: herabgesetztes Vibrationsempfinden der Beine,
distal betont, Parästesien der Beine, PSR, AST
oB und seitengleich.</item>
</list>
</text>
Dasselbe Beispiel in der Ansicht eines Browsers (mittels Stylesheet).
- Pulmo: Basal diskrete RGs
- Cor: oB
- Abdomen: weich, Peristaltik: +++
- Muskulatur: atrophisch
- Mundhöhle: Soor, Haarkoplakie
- Haut blass, seborrhoisches Ekzem, Schleimhäute blass, Hautturgor herabgesetzt
- Neuro: herabgesetztes Vibrationsempfinden der Beine, distal betont, Parästesien der Beine, PSR, AST oB und seitengleich.
|
|
Die Reihenfolge der Darstellung richtet sich nach der Reihenfolge im CDA Dokument. |
Tabellen
Zur Repräsentation medizinischer Inhalte, die sich adäquat tabellarisch darstellen lassen, bietet sich die Tabellenform an. Als Beispiele seien genannt: Laborwerte, Allergiewerte, Diagnose mit ICD-Verschlüsselung etc. CDA realisiert ein vereinfachtes XHTML Table Modell, das HTML sehr ähnelt. Eine Tabelle wird angedeutet mit dem table Element. Als Attribut ist hier @border vorgesehen, das die Breite der Umrahmung angibt.
<table border="1">
''...Tabellen-Elemente''
</table>
Eine Tabelle besteht aus einer oder mehreren Spalten. In der ersten Zeile werden die Spaltenüberschriften aufgeführt. Die Tabellenüberschrift wird eingeschlossen in thead Tags, die Überschriftenzeile in tr Tags und die einzelnen Spalten-Items der Überschrift mit th Tag.
<table>
<thead>
<tr> <!-- Überschrift-Zeile -->
<th> Spaltenüberschrift 1</th>
...
<th> Spaltenüberschrift n</th>
</tr>
</thead>
...
</table>
Die eigentlichen Inhalte werden in tbody Tags, die Datenzeile in tr Tags und die einzelnen Spalteninhalte einer Datenzeile mit td Tag gekapselt. Insgesamt hat eine Tabelle formal das folgende Aussehen:
<table>
<thead>
<tr> <!-- Überschrift-Zeile -->
<th> Spaltenüberschrift 1</th>
...
<th> Spaltenüberschrift n</th>
</tr>
</thead>
<tbody>
<tr> <!-- 1. Zeile mit Daten -->
<td>Inhalt Spalte 1 in Zeile 1</td>
...
<td>Inhalt Spalte n in Zeile 1</td>
</tr>
...
<tr> <!-- m. Zeile mit Daten -->
<td>Inhalt Spalte 1 in Zeile m</td>
...
<td>Inhalt Spalte n in Zeile m</td>
</tr>
</tbody>
</table>
Das folgende Beispiel zeigt die Repräsentation einer Diagnose in Tabellenform, wobei die Spaltenüberschriften lauten: "Diagnose", "ICD Code", "Lokalisation" und "Zusatz"
<table>
<thead>
<tr>
<th>Diagnose</th>
<th>ICD Code</th>
<th>Lokalisation</th>
<th>Zusatz</th>
</tr>
</thead>
<tbody>
<tr>
<td>Tuberkulose des Ohres</td>
<td>A18.6</td>
<td>R</td>
<td>G</td>
</tr>
<tr>
<td>Ausschluss Lungenemphysem</td>
<td>J43.9</td>
<td>--</td>
<td>A</td>
</tr>
<tr>
<td>V. a. Allergische Rhinopathie durch Pollen</td>
<td>J31.1</td>
<td>--</td>
<td>V</td>
</tr>
</tbody>
</table>
[Abbildung 14] Dasselbe Beispiel in der Ansicht eines Browsers (mittels Stylesheet).
Unterabschnitte
Zur Strukturierung eines längeren Textes kann das paragraph Tag verwendet werden. Beispiel:
<text>
<paragraph> Sollten nach der empfohlenen Medikation mit Atemur die
klinischen Zeichen weiterhin bestehen, halte ich bei dem umfangreichen
Risikoprofil einen Kuraufenthalt für zwingend notwendig.</paragraph>
<paragraph> Ich bitte dann um Wiedervorstellung des Patienten.
</paragraph>
</text>
Überschriften
Mit dem caption Element kann man Paragrafen, Listen, Listenelemente, Tabellen oder Tabellenzellen mit einer Beschreibung („Überschrift") versehen. Ein caption Element enthält Text und kann Verweise (Links) oder Fußnoten enthalten.
Superskripts und Subskripts
Diese Gestaltungsmöglichkeiten sind im CDA-Standard beschrieben, werden aber in diesem Leitfaden noch nicht genutzt.
Zeilenumbrüche
Das br Element <br/> kann benutzt werden, um im laufenden Text einen „harten" Zeilumbruch zu erzwingen. Dies unterscheidet sich vom paragraph Element, da der Zeilenumbruch keinen Inhalt hat. Empfänger sind gehalten, dieses Element als Zeilenumbruch darzustellen.
Beispiel
<text>
Patient hat Asthma seit seinem zehnten Lebensjahr.<br/>
Patient kommt damit gut zurecht.
</text>
Fußnoten
Diese Gestaltungsmöglichkeiten sind im CDA-Standard beschrieben, werden aber in diesem Leitfaden noch nicht genutzt.
Sonstige Zeichenstile
Mittels des @styleCode Attributs im Textteil, das in content Elementen verwendet werden kann, ist es möglich, Vorschläge des Autors des Dokuments bezüglich der Visualisierung von umschlossenen Textteilen zu beschreiben. Der Empfänger ist nicht verpflichtet, den Text tatsächlich so visuell darzustellen, wie es die Vorschläge andeuten. Bisher werden im Rahmen dieses Leitfadens die folgenden Style-Codes unterstützt, die in beliebiger Reihenfolge genutzt werden können.
| Font-Stil-Angaben (Änderung der Font-Charakteristik) | |
|---|---|
| Code | Definition |
| Bold | Fettdruck |
| Underline | Unterstrichen |
| Italics | Kursivschrift |
| Emphasis | Betont |
[Tabelle 4] Stil-Codes für den narrativen Text
<text>
Einiges vom Text wird <content styleCode="Bold">im Fettdruck</content>
dargestellt, anderes in <content styleCode="Bold Italics">fetter
Kursivschrift</content>.
</text>
Referenzierter Inhalt (content)
Das CDA content Element wird benutzt, um Text ausdrücklich mit Tags „einzurahmen", so dass er referenziert werden kann oder bestimmte Möglichkeiten zur visuellen Darstellung genutzt werden können. Das content Element kann rekursiv ineinander geschachtelt werden, was die Einrahmung von ganzen Texten bis hin zu kleinsten Teilen (Worte, Buchstaben etc.) erlaubt.
Das content Element enthält ein optionales Identifikator Attribut, das als Ziel einer XML Referenz dienen kann. Alle diese IDs sind als XML IDs definiert und müssen im gesamten Dokument eindeutig sein. Die originalText Komponente einer RIM Klasse, die sich in den CDA Entries (siehe unten) wieder findet, kann sich somit explizit auf die vom content Element im Textteil umschlossene Information beziehen.
Im Beispiel wird das Textstück Asthma durch das content Element eingerahmt, so dass in einem möglichen Level 3 Entry darauf Bezug genommen werden kann (originalText.reference, siehe unten).
Beim Patienten wurde <content ID="diag-1">Asthma</content> diagnostiziert.
Das content Element wird auch zur Einrahmung von Text benutzt, der in einem, bestimmten Stil dargestellt werden soll, was mit dem @styleCode Attribut (siehe unten) näher beschrieben wird.
Referenz zu (externen) Multimedia-Inhalten
Es ist möglich, zusätzlich zu dem Text auch Referenzen auf externe Multimediaobjekte wie Bilder etc. zu spezifizieren. Dies geschieht über das renderMultiMedia Element und dient dazu aufzuzeigen, wo das Multimedia-Objekt gezeigt/dargestellt werden soll.
Das renderMultiMedia Element hat ein optionales caption Element. Es weist außerdem die Referenz (XML ID) zum erforderlichen Objekt auf, die als XML IDREF im selben Dokument definiert sein muss. XML ID und IDREF sind also korrespondierende Definitionen (einmalig) und Referenzen darauf (mehrfach möglich) eines CDA Entry ObservationMedia (oder RegionOfInterest) im selben Dokument.
Das renderMultiMedia Element trägt dabei im @referencedObject Attribut die ID.
Die Information zum eigentlichen Objekt wird in einem CDA Entry festgehalten. Für diesen Leitfaden wird ausschließlich das Element observationMedia verwendet.
Dieser Eintrag trägt im entry Element unter anderem das @ID Attribut als Zielreferenz des @referencedObject Attributs vom renderMultiMedia Element.
ObservationMedia Klasse
Die Klasse ObservationMedia selbst ist im Prinzip ein Clinical Statement, wobei die im Folgenden genannten Elemente möglich sind.
[Abbildung 15] ObservationMedia CDA Entry zur Darstellung der Informationen eines Multimedia-Objektes.
Eine detaillierte Beschreibung ist beim entsprechenden Template Eingebettetes Objekt Entry angegeben.
Regel OMVL: Wenn die Klasse observationMedia genutzt wird, muss sie ein value Element mit dem eigentlichen Objekt enthalten.
Vokabular
Der Datentyp von Multimedia-Objekten ist immer ED (encapsulated data). Dabei ist auch der Medientyp (MIME) im entsprechenden @mediaType Attribut zu nennen. Zugelassen sind hier zunächst nur die folgenden Mime-Typen. Als „verpflichtend", also als zu unterstützen, werden die Typen text/plain, application/pdf sowie audio/mpeg, image/png, image/jpeg und video/mpeg eingestuft.
| Diese Terminologie ist eine Momentaufnahme vom . Terminologien können sich im Laufe der Zeit weiterentwickeln. Wenn eine neuere (dynamische) Versionen dieser Terminologie benötigt wird, bitte von der Quelle abrufen. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Id | 1.2.276.0.76.11.14 | Gültigkeit | 2014‑08‑25 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | Mediatypes | Bezeichnung | Medientypen | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Quell-Codesystem | 1.2.840.10003.5.109 - FHIR: urn:oid:1.2.840.10003.5.109 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Legende: Typ L=leaf, S=specializable, A=abstract, D=deprecated. NullFlavor OTH (other) schlägt Text in originalText vor. HL7 V3: NullFlavors werden im @nullFlavor Attribut statt in @code angegeben. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
[Tabelle 5] mediaType Attribut Werte (Datenarten)
Beispiel
Das in observationMedia.value befindliche reference Element enthält als Wert den Verweis auf das eigentliche Multimedia-Objekt.
Das folgende Beispiel beschreibt einen Befund am linken Zeigefinger, der zusätzlich mit einem Bild dokumentiert ist.
<section>
<code code="8709-8" codeSystem="2.16.840.1.113883.6.1"
codeSystemName="LOINC"/>
<title>Untersuchung der Haut</title>
<text>Rötung an der Palmarfläche des linken Zeigefingers
<renderMultiMedia referencedObject="MM1"/>
</text>
<entry>
<observationMedia classCode="OBS" moodCode="EVN">
<templateId root="1.2.276.0.76.10.4014"/>
<value mediaType="image/jpeg">
<reference value="lefthand.jpeg"/>
</value>
</observationMedia>
</entry>
</section>
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Datentypen
Die verschiedenen Templates (Header, Section und Entry) benutzen verschiedene Datentypen in speziellen Ausprägungen. Diese werden nachfolgend kurz aufgelistet. Eine detaillierte Erläuterung findet sich im Wiki unter dem Implementierungsleitfaden zu den Datentypen und den unterstützten Datentypen bei ART-DECOR.
| Datentyp | DT | Ausprägung | Erläuterung, Beispiel |
|---|---|---|---|
| Adressen | AD | hier zu beachten: AD.DE Adresse in Deutschland | allgemeine Adresse, Geburtsort |
| boolesche Werte | BL | Ja/Nein-Informationen | |
| kodierte Informationen | CD | ||
| kodierte Informationen | CE | ||
| kodierte Informationen | CR | ||
| kodierte Informationen | CS.LANG | ||
| kodierte Informationen | CV | ||
| Encapsulated Data | ED | ||
| Identifikation | II | ||
| Ganzzahlen | INT | ||
| nicht-negative Ganzzahlen | INT.NONNEG | ||
| Zeitintervalle | IVL_TS | ||
| Namen für Organisationen und Institutionen | ON | ||
| Namen für Personen | PN | hier zu beachten: PN.DE Namensnutzung in Deutschland | |
| physikalische Mengenangaben | PQ | ||
| String mit Codes | SC | ||
| Text in CDA-Sections | SD.TEXT | ||
| Zeichenketten | ST | ||
| Kontaktinformationen | TEL | Telefon, Telefax und Emailadressen | |
| Zeitpunkte | TS | Datum und Uhrzeit | |
| Zeitpunkte | TS.DATE.MIN | mindestens YYYYMMDD | |
| Zeitpunkte | TS.DATETIME.MIN | mindestens YYYYMMDDhhmmss | |
| URLs | URL |
[Tabelle 6] CDA Datentypen
Identifikationen
Die lebenslange Arztnummer (LANR) löste im Bereich der Niedergelassenen, gemeinsam mit der Betriebsstättennummer (BSNR), zum 1. Juli 2008 die bisherige Arztnummer (ANR) ab. Seitdem müssen alle Vertragsärzte und -psychotherapeuten bei der Abrechnung von Leistungen die zwei jeweils neunstelligen Nummern angeben. Grundlage für die Nummernvergabe ist die Richtlinie der KBV zur Vergabe der Arzt- und Betriebsstättennummern (§ 75 Abs. 7 Fünftes Sozialgesetzbuch). [17]
Die meisten Dokumente sind zudem mit einem Peronalienfeld mit vorgegebenem Inhalt versehen. Diese betreffen sowohl Personen (Gesundheitsdienstleister) als auch Organisationen (Praxis etc.). Die zugehörigen Identifikations-Schemata können lokaler Natur sein (eigene Nummernkreise) oder zum Beispiel als LANR bzw. BSNR ausgedrückt werden.
Für LANR und BSNR sind folgende OIDs zugewiesen:
- LANR 1.2.276.0.76.4.16
- BSNR 1.2.276.0.76.4.17
Beispiele:
<id extension="321997903" root="1.2.276.0.76.4.16"/>
<id extension="411912300" root="1.2.276.0.76.4.17"/>
Templates für den Arztbrief
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Dokumentenstruktur Arztbrief
Ein Arztbrief - wie andere Dokumente auch - setzt sich aus verschiedenen Teilen zusammen.
- die Attribute der CDA-Klasse
- Informationen über die verschiedenen Beteiligten an einem Dokument wie Patient, Autor, Unterzeichner etc.
- Informationen über Aktivitäten, die in Zusammenhang mit dem Dokument stehen.
Attribute der CDA-Klasse
Die folgende Tabelle gibt eine Übersicht über die in diesem Leitfaden besprochenen CDA-Header-Elemente, deren Datentyp und Bedeutung. Details und weitere Erläuterungen find sich aber der Beschreibung des Dokumenten-Level-Template.
| Name | DT | Beschreibung |
|---|---|---|
| realmCode | CS | Hoheitsangabe, d.h. wo dieser Dokumenttyp eingesetzt werden soll, hier in der Regel "DE" |
| templateId | II | Angabe, nach welchem Schema das Dokument erstellt wurde |
| typeId | II | Angabe, dass es sich um ein CDA-Dokument handelt |
| id | II | eindeutige Identifikation des Dokuments |
| code | CE | Typ des Dokuments |
| title | ST | Titel bzw. Bezeichnung des Dokuments |
| effectiveTime | TS | Erstellungszeitpunkt |
| confidentialityCode | CE | Vertraulichkeit |
| languageCode | CS | Sprache des Dokuments |
| setId | II | Set-Kennung |
| versionNumber | INT | Versionsnummer |
[Tabelle 7] Übersicht über die (in diesem Leitfaden besprochenen) CDA-Header-Elemente, deren Datentyp bzw. Bedeutung und deren Kardinalität
Beispiel
<?xml version="1.0"? encoding="UTF-8">
<ClinicalDocument
xmlns="urn:hl7-org:v3"
xmlns:xsi="http://www.w3.org/2001/XMLSchema-instance">
<!-- CDA Header -->
<typeId root="2.16.840.1.113883.1.3" extension="POCD_HD000040"/>
<id extension="60878,33988" root="1.2.276.0.58"/>
<code code="11488-4" codeSystem="2.16.840.1.113883.6.1" displayName="Consultation note"/>
<title>Entlassbrief</title>
<effectiveTime value="20070905"/>
<confidentialityCode code="N" codeSystem="2.16.840.1.113883.5.25"/>
<languageCode code="de" />
<setId extension="D1" root="2.16.840.1.113883.3.933"/>
<versionNumber value="2"/>
...
</ClinicalDocument>
Informationen über die verschiedenen Beteiligten und Aktivitäten, die in Zusammenhang mit dem Dokument stehen
Die folgende Tabelle zeigt die Informationen über die verschiedenen Beteiligten und Aktivitäten, die in Zusammenhang mit dem Dokument stehen. Aufgenommen in der Tabelle sind auch Referenzen zu den Definitionen der ELGA (Österreich), die mitunter kein direktes Äquivalent haben und dann unter einem Oberbegriff geführt werden.
| Abschnitt | Conf. | Kardinalität | Kommentar |
|---|---|---|---|
| Header (über Rollen) | |||
| Patient (recordTarget) | M | 1..1 | |
| Autor (Person) (author) | M | 1..1 | das Autor Element darf nur für natürliche Personen verwendet werden, nicht für Informationssysteme oder medizin-technische Geräte |
| Datentypist (dataEnterer) | O | 0..1 | |
| Informant (informant) | O | 0..* | |
| die das Dokument verwaltende Organisation ( custodian) | M | 1..1 | |
| Empfänger (informationRecipient) | O | 0..* | |
| vor dem Gesetz verantwortliche Unterzeichner (legalAuthenticator) | O | 0..1 | Hier darf es nur eine juristisch verantwortliche Person geben. |
| Unterzeichner (authenticator) | O | 0..* | Einen Brief dürfen aber mehrere Personen unterzeichnen. |
| einweisender Arzt | O | 0..1 | |
| Hausarzt | O | 0..1 | |
| Notfallkontakt | O | 0..* | |
| Angehörige | O | 0..* | |
| Kostenträger , Versicherung | O | 0..* | |
| Fachlicher Ansprechpartner | O | 0..* | |
| Betreuungsorganisation | O | 0..* | |
| Weitere Beteiligte (generisch) | - | - | |
| Header (über Act-Relationships) | |||
| Patientenkontakt (EncompassingEncounter) | O | 0..1 | |
| Einwilligung | O | 0..* | wozu hat der Patient eingewilligt? |
| unstrukturierter Body (d.h. ohne Abschnitte) | |||
| NonXML-Body | O | 0..1 | |
| strukturierter Body (d.h. Abschnitte) | |||
| Anrede | O | 0..1 | ELGA: Brieftext |
| Fragestellung | O | 0..1 | ELGA: Aufnahmegrund |
| Anamnese | O | 0..1 | ELGA: Anamnese (ärztlich) |
| Schwangerschaften | O | 0..1 | |
| Familienanamnese | O | 0..1 | |
| frühere Erkrankungen | O | 0..1 | ELGA: frühere Erkrankungen |
| Medizinische Untersuchung | O | 0..1 | klinische (körperliche) oder apparative Untersuchung |
| Befund | O | 0..* | ELGA: Erhobene Befunde |
| Laborwerte | O | 0..1 | |
| Diagnosen (Aufnahme/Entlassung) mit ICD Code | O | 0..* | |
| Diagnosen (Aufnahme/Entlassung) | ELGA: Diagnose bei Entlassung | ||
| besondere Hinweise (CAVE)
(zu beachtende wichtige Hinweise zum Patienten) |
O | 0..* | |
| besondere Hinweise | O | 0..* | ELGA: Allergien, Unverträglichkeiten, Risiken |
| Prozeduren und Maßnahmen | O | 0..* | ELGA: Weitere Maßnahmen |
| ELGA: Durchgeführte Maßnahmen | |||
| Medikation (abstrakte Spezifikation) | - | - | Dies ist die vollständige Beschreibung, die für die nachfolgend beschriebenen Abschnitte weiter eingeschränkt wird. |
| jetzige Medikation | O | 0..1 | ELGA: Letzte Medikation |
| empfohlene Medikation | ELGA: Empfohlene Medikation | ||
| Medikation bei Aufnahme | O | 0..1 | ELGA: Medikation bei Einweisung |
| Medikation bei Entlassung | O | ELGA: "Verabreichte Medikation während des Aufenthalts| | |
| Impfung | O | 0..1 | |
| Notiz | O | 0..* | |
Epikrise
|
O | 0..1 | ELGA: Zusammenfassung des Aufenthalts; Epikrise streichen und durch die Details ersetzen; Plan of Care |
| Schlusstext | O | 0..1 | ELGA: Abschließende Bemerkungen |
| Anhänge: Referenzen auf externe Dokumente oder direkt inkludierte Objekte |
O | 0..* | ELGA: Beilagen Das Entry-Level-Template für externe Referenzen ist dafür gedacht, einzelne Aktivitäten (bspw. Befunde oder Maßnahmen) mit Dokumenten zu belegen. |
| ELGA: Patientenverfügung (als Referenz auf die Patienteneinwilligung) | |||
[Tabelle 8]Informationen über die verschiedenen Beteiligten und Aktivitäten
|
|
Der Ersteller des Dokuments muss festlegen, ob er einen nicht XML-basierten Body (NonXMLBody) oder auf XML-basierende Abschnitte (section) benutzen möchte. |
Ein Arztbrief kann somit entweder in einem Binärformat als PDF o.ä. Dokument oder XML-formatiert übermittelt werden, und sich entweder ohne Strukturvorgabe oder aus strukturierten Abschnitten zusammensetzen.
Dokument-Level-Template für den Arztbrief
| Id | 1.2.276.0.76.10.1013 | Gültigkeit | 2014‑08‑25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | v2.02 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | Arztbrief | Bezeichnung | Arztbrief 2014/2015 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beschreibung | Ärztlicher Entlassbrief Version 2014, Nachfolger des VhitG-Arztbriefs aus dem Jahr 2006 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kontext | Pfadname / | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Document Level Template | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Benutzt | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Spezialisierung: Template 2.16.840.1.113883.10.12.1 CDA ClinicalDocument (DYNAMIC) ref ad1bbr- | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beispiel |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Header-Level-Templates für den Arztbrief
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Patient (recordTarget - generisch)
| Id | 1.2.276.0.76.10.2001 | Gültigkeit | 2013‑07‑10 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | HeaderRecordTarget | Bezeichnung | CDA recordTarget | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Header Level Template | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Benutzt |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Spezialisierung: Template 2.16.840.1.113883.10.12.101 CDA recordTarget (DYNAMIC) ref ad1bbr- | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beispiel |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beispiel |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beispiel |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Autor (author - generisch)
| Id | 1.2.276.0.76.10.2002 | Gültigkeit | 2013‑07‑10 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | HeaderAuthor | Bezeichnung | CDA author | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beschreibung | Die Autor-Relation gibt den Urheber der Dokumentation und den Zeitpunkt der Autorenschaft wieder. Dies sind in der Regel Personen (Gesundheitsdienstleister) oder auch Geräte, die Daten erzeugen. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Header Level Template | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Benutzt |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Spezialisierung: Template 2.16.840.1.113883.10.12.102 CDA author (DYNAMIC) ref ad1bbr- | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beispiel |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beispiel |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Autor (author - Person)
| Id | 1.2.276.0.76.10.2007 | Gültigkeit | 2013‑10‑11 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | HeaderAuthorPerson | Bezeichnung | CDA author Person | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beschreibung | Dieses Template spezifiziert, wie ein Mensch/Person als Autor des Dokumentes angegeben wird. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Header Level Template | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Benutzt |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Spezialisierung: Template 1.2.276.0.76.10.2002 CDA author (DYNAMIC) Spezialisierung: Template 2.16.840.1.113883.10.12.102 CDA author (DYNAMIC) ref ad1bbr- | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beispiel |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Verwaltende Organisation (custodian - generisch)
| Id | 1.2.276.0.76.10.2004 | Gültigkeit | 2020‑03‑29 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | HeaderCustodian | Bezeichnung | CDA custodian | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beschreibung | Verantwortliche Organisation für ein erstelltes Dokument (die das Dokument verwaltende Organisation). In der Regel ist es die erstellende Institution des Dokumentes. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Header Level Template | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Participant: Empfänger (informationRecipient)
| Id | 1.2.276.0.76.10.2005 | Gültigkeit | 2013‑07‑10 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | HeaderInformationRecipient | Bezeichnung | CDA informationRecipient | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Header Level Template | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Benutzt |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beispiel |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Unterzeichner gesetzlich verantwortlich (legalAuthenticator - generisch)
| Id | 1.2.276.0.76.10.2020 | Gültigkeit | 2014‑08‑25 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | HeaderLegalAuthenticator | Bezeichnung | CDA legalAuthenticator | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beschreibung | Vor dem Gesetz verantwortliche Unterzeichner des Dokumentes | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Header Level Template | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Benutzt |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Spezialisierung: Template 2.16.840.1.113883.10.12.106 CDA legalAuthenticator (2005‑09‑07) ref ad1bbr- | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beispiel |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Unterzeichner (authenticator - generisch)
| Id | 1.2.276.0.76.10.2019 | Gültigkeit | 2014‑08‑25 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | HeaderAuthenticator | Bezeichnung | CDA authenticator | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beschreibung | Unterzeichner des Dokumentes (weitere neben dem vor dem Gesetz verantwortlichen Unterzeichner) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Header Level Template | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Benutzt |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Spezialisierung: Template 2.16.840.1.113883.10.12.107 CDA authenticator (2005‑09‑07) ref ad1bbr- | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beispiel |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Participant: Datentypist (dataEnterer)
| Id | 1.2.276.0.76.10.2017 | Gültigkeit | 2014‑08‑25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | HeaderDataEnterer | Bezeichnung | CDA dataEnterer | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beschreibung | Datentypist, die bei der Dateneingabe beteiligte Person(en) wie die Sekretärin u.a. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Header Level Template | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Benutzt |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Spezialisierung: Template 2.16.840.1.113883.10.12.103 CDA dataEnterer (2005‑09‑07) ref ad1bbr- | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Participant: Informant (informant)
| Id | 1.2.276.0.76.10.2018 | Gültigkeit | 2014‑08‑25 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | CDAinformant | Bezeichnung | CDA Informant | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beschreibung | Informant, Personen, die Informationen zu dem Arztbrief beigesteuert haben (i.d.R. natürliche Personen, die nicht als Leistungserbringer agieren) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Header Level Template CDA Entry Level Template | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Benutzt |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Spezialisierung: Template 2.16.840.1.113883.10.12.319 CDA Informant (Body) (2005‑09‑07) ref ad1bbr- | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beispiel |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beispiel |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Weitere Beteiligte
| Id | 1.2.276.0.76.10.2024 | Gültigkeit | 2014‑08‑25 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | HeaderParticipant | Bezeichnung | CDA participant Weitere Beteiligte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Header Level Template | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Benutzt |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Spezialisierung: Template 2.16.840.1.113883.10.12.108 CDA participant (2005‑09‑07) ref ad1bbr- | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Einweisender Arzt
| Id | 1.2.276.0.76.10.2023 | Gültigkeit | 2014‑08‑25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | HeaderParticipantEinweiser | Bezeichnung | CDA participant Einweiser | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beschreibung | Einweisender/Zuweisender Arzt | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Header Level Template | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Benutzt |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Spezialisierung: Template 1.2.276.0.76.10.2024 CDA participant Weitere Beteiligte (DYNAMIC) Spezialisierung: Template 2.16.840.1.113883.10.12.108 CDA participant (2005‑09‑07) ref ad1bbr- | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Hausarzt
| Id | 1.2.276.0.76.10.2012 | Gültigkeit | 2013‑11‑22 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | HeaderParticipantHausarzt | Bezeichnung | CDA participant Hausarzt | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beschreibung | Hausarzt | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Header Level Template | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Benutzt |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beispiel |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Notfallkontakt
| Id | 1.2.276.0.76.10.2011 | Gültigkeit | 2013‑11‑22 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | HeaderParticipantNotfallkontakt | Bezeichnung | CDA participant Notfallkontakt | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beschreibung | Notfall-Kontakt / Auskunftsberechtigte Person | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Header Level Template | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Benutzt |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beispiel |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Angehörige (Template)
| Id | 1.2.276.0.76.10.2021 | Gültigkeit | 2014‑08‑25 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | HeaderParticipantAngehoerige | Bezeichnung | CDA participant Angehörige | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beschreibung | Angehörige oder Wohnpartner des Patienten | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Header Level Template | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Benutzt |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Spezialisierung: Template 1.2.276.0.76.10.2024 CDA participant Weitere Beteiligte (DYNAMIC) Spezialisierung: Template 2.16.840.1.113883.10.12.108 CDA participant (2005‑09‑07) ref ad1bbr- | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beispiel |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Versicherter/Versicherung
| Id | 1.2.276.0.76.10.2022 | Gültigkeit | 2014‑08‑25 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | HeaderParticipantKostentraeger | Bezeichnung | CDA participant Kostentraeger | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Header Level Template | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Benutzt |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Spezialisierung: Template 1.2.276.0.76.10.2024 CDA participant Weitere Beteiligte (DYNAMIC) Spezialisierung: Template 2.16.840.1.113883.10.12.108 CDA participant (2005‑09‑07) ref ad1bbr- | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beispiel |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Patientenkontakt (EncompassingEncounter - generisch)
| Id | 1.2.276.0.76.10.2027 | Gültigkeit | 2014‑08‑25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | 1.1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | HeaderEncompassingEncounter | Bezeichnung | CDA encompassingEncounter Patientenkontakt | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Header Level Template | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Benutzt |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beispiel |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Section-Level-Templates für den Arztbrief
Ein Arztbrief kann im Body
- entweder unstrukturiert als PDF o.ä. Dokument übermittelt werden (non-structured body),
- oder sich aus strukturierten Abschnitten zusammensetzen (structured body).
Das Element <component> enthält dazu entweder ein Element <nonXMLBody> mit dem unstrukturierten Informationen oder <structuredBody> mit Sections (Abschnitten).
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Section: Non-XML-Body
Es gibt für die unstrukturierte Wiedergabe im so genannten nonXMLBody zwei Varianten:
- Unstrukturierter Body mit eingebettetem Dokument (z. B. PDF), Base64-encoded als Elementinhalt im text-Element
- Unstrukturierter Body mit referenziertem Dokument (z. B. PDF), als URL/URI in reference/@value.
Für beide Situationen ist jeweils ein Template vorhanden, das die eine oder andere Situation beschreibt.
|
|
Der Einsatz von CDAs mit eingebetteten oder referenzierten Dokumenten birgt einige technische Risiken. Die Anzeige solcher CDAs mit non-structured bodies ist vor allem in Web-basierten Anwendungen nur durch dedizierte Viewer oder durch eine spezialisierte Vorverarbeitung darstellbar. Ein Arztbrief mit einem structured body kann hingegen durch einen einfachen XML Stylesheet in jedem Browser dargestellt werden. Bei eingebetteten Dokumenten ist zusätzlich der höhere Platzbedarf (ca. 33% zusätzlicher Speicherbedarf verglichen mit einem strukturierten Body) wegen der ineffizienten base64-Kodierung zu bedenken. Aufgrund dieser technischen Limitationen sollten Projekt- oder Produktverantwortliche vor einer Entscheidung für unstrukturierte Bodies eine umfangreiche Abwägung der Risiken vornehmen. |
Unstrukturierter Body mit referenziertem Dokument
| Id | 1.2.276.0.76.10.3036 | Gültigkeit | 2014‑08‑25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | BodyNonXMLBodyReferenced | Bezeichnung | CDA nonXMLBody (referenziert) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beschreibung | Unstrukturierter Body | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Section level template | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Unstrukturierter Body mit eingebettetem Dokument
| Id | 1.2.276.0.76.10.3038 | Gültigkeit | 2014‑09‑26 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | BodyNonXMLBodyEmbedded | Bezeichnung | CDA nonXMLBody (eingebettet) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beschreibung | Unstrukturierter Body | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Section level template | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Section: Anrede
| Id | 1.2.276.0.76.10.3001 | Gültigkeit | 2013‑01‑10 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | Salutation | Bezeichnung | Anrede | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kontext | Elternknoten des Template-Element mit Id 1.2.276.0.76.10.3001 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Section level template | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Spezialisierung: Template 2.16.840.1.113883.10.12.201 CDA Section (2005‑09‑07) ref ad1bbr- | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beispiel |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Anmerkung: LOINC Codes mit einem vorangestellten X, wie hier X-SALUT, werden kurzfristig durch tatsächliche numerische LOINC Codes ersetzt. |
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Section: Grund der Überweisung
| Id | 1.2.276.0.76.10.3002 | Gültigkeit | 2013‑09‑16 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | ReasonForReferral | Bezeichnung | Grund der Überweisung Section | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kontext | Elternknoten des Template-Element mit Id 1.2.276.0.76.10.3002 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Section level template | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Adaptation: Template 1.3.6.1.4.1.19376.1.5.3.1.3.1 IHE Reason for Referral Section (DYNAMIC) ref IHE-PCC- Adaptation: Template 1.2.40.0.34.11.2.2.1 Aufnahmegrund (DYNAMIC) ref elgabbr- Spezialisierung: Template 2.16.840.1.113883.10.12.201 CDA Section (2005‑09‑07) ref ad1bbr- | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beispiel |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Section: Anamnesen
In diesem Leitfaden werden die folgenden Anamnese-Informationen unterstützt.
Jetzige Anamnese
| Id | 1.2.276.0.76.10.3022 | Gültigkeit | 2013‑12‑30 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | Historyofpresentillnesssection | Bezeichnung | Jetzige Anamnese | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beschreibung | Jetzige Anamnese | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Section level template | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Spezialisierung: Template 2.16.840.1.113883.10.12.201 CDA Section (2005‑09‑07) ref ad1bbr- | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Frühere Erkrankungen
| Id | 1.2.276.0.76.10.3023 | Gültigkeit | 2013‑12‑30 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | Historyofpastillnesssection | Bezeichnung | Frühere Erkrankungen | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beschreibung | Liste der bisherigen Krankheiten des Patienten | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Section level template | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Spezialisierung: Template 2.16.840.1.113883.10.12.201 CDA Section (2005‑09‑07) ref ad1bbr- | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Familienanamnese
| Id | 1.2.276.0.76.10.3024 | Gültigkeit | 2013‑12‑30 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | Familyhistorysection | Bezeichnung | Familienanamnese | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beschreibung | Angaben über Erkrankungen macht, die bei Verwandten des Patienten aufgetreten sind. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Section level template | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Spezialisierung: Template 2.16.840.1.113883.10.12.201 CDA Section (2005‑09‑07) ref ad1bbr- | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Section: Verabreichte Impfungen
| Id | 1.2.276.0.76.10.3012 | Gültigkeit | 2013‑07‑15 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | Immunizationssection | Bezeichnung | Verabreichte Impfungen | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beschreibung | Verabreichte Impfungen und ausdrücklich nicht erwünschten Impfungen. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kontext | Elternknoten des Template-Element mit Id 1.2.276.0.76.10.3012 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Section level template | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Spezialisierung: Template 2.16.840.1.113883.10.12.201 CDA Section (2005‑09‑07) ref ad1bbr- | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Section: Erhobene Befunde
| Id | 1.2.276.0.76.10.3025 | Gültigkeit | 2013‑12‑30 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | Hospitaldischargestudiessummarysection | Bezeichnung | Erhobene Befunde (Krankenhaus) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beschreibung | Im Krankenhaus erhobene Befunde | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Section level template | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Spezialisierung: Template 2.16.840.1.113883.10.12.201 CDA Section (2005‑09‑07) ref ad1bbr- | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beispiel |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Section: Diagnosen
Die Diagnosen werden im Arztbrief im Idealfall
- in Level 1 zur direkten Ausgabe formatiert,
- in Level 2 als Diagnose markiert und
- in Level 3 codiert angegeben (im jetzigen Leitfaden nicht beschrieben, sondern alleinig in den nicht-normativen Einzelabschnitten zu den Diagnosen wiedergegeben):
Die folgenden Typen von Diagnosen werden in den entsprechenden Sektionen wiedergegeben.
Aufnahmediagnose
| Id | 1.2.276.0.76.10.3026 | Gültigkeit | 2013‑12‑30 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | Admissiondiagnosissection | Bezeichnung | Aufnahmediagnose | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beschreibung | Speziell gekennzeichnete Diagnose, die im Verlauf der Aufnahmeuntersuchung gestellt wird. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Section level template | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Spezialisierung: Template 2.16.840.1.113883.10.12.201 CDA Section (2005‑09‑07) ref ad1bbr- | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Entlassungsdiagnose
| Id | 1.2.276.0.76.10.3027 | Gültigkeit | 2013‑12‑30 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | Dischargediagnosissection | Bezeichnung | Entlassungsdiagnose | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beschreibung | Diagnose, mit der der Patient entlassen wurde | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Section level template | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Spezialisierung: Template 2.16.840.1.113883.10.12.201 CDA Section (2005‑09‑07) ref ad1bbr- | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Textformatierung für Diagnosen (auf Level 1)
Das nachfolgende Beispiel zur Textformatierung zeigt die Nutzung von Tabellen am Beispiel der Diagnosen.
Beispiel
<component>
<!-- Diagnose mit ICD Komponente auf CDA Level 2-->
<section>
<code code="29548-5" codeSystem="2.16.840.1.113883.6.1" codeSystemName="LOINC"/>
<title>29.08.2005: Diagnosen mit ICD 10</title>
<text>
<table border="1">
<thead>
<tr>
<th>Diagnose</th>
<th>ICD Code</th>
<th>Lokalisation</th>
<th>Zusatz</th>
</tr>
</thead>
<tbody>
<tr>
<td><content ID ="DIAG200508291">Allergisches Asthma</content></td>
<td>J45.0</td>
<td>--</td>
<td>G</td>
</tr>
<tr>
<td><content ID ="DIAG200508292">Ausschluss Lungenemphysem</content></td>
<td>J43.9</td>
<td>--</td>
<td>A</td>
</tr>
<tr>
<td><content ID ="DIAG200508293">V.a. Allergische Rhinopathie durch Pollen</content></td>
<td>J31.1</td>
<td>--</td>
<td>V</td>
</tr>
</tbody>
</table>
</text>
</section>
</component>
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Section: Allergien, Unverträglichkeiten, Risiken
In diesem Abschnitt (auch CAVE genannt) werden
- Hinweise zu Risikofaktoren beim Patienten und
- Allergien
abgebildet.
| Id | 1.2.276.0.76.10.3028 | Gültigkeit | 2013‑12‑30 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | Allergiesintolerancesriskssection | Bezeichnung | Allergien, Unverträglichkeiten, Risiken | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beschreibung | Beschreibung der Allergien, Unverträglichkeiten und Risiken und deren beobachteten Nebenwirkungen, sowie sonstiger Risiken. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Section level template | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Spezialisierung: Template 2.16.840.1.113883.10.12.201 CDA Section (2005‑09‑07) ref ad1bbr- | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beispiel |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Section: Medikationen
In diesem Leitfaden werden folgende Templates zu Medikations-Informationen unterstützt:
Medikation bei Einweisung (Historie)
| Id | 1.2.276.0.76.10.3029 | Gültigkeit | 2013‑12‑30 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | Admissionmedicationsection | Bezeichnung | Medikation bei Einweisung (Historie) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beschreibung | Erhobene Medikation bei Aufnahme des Patienten. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Section level template | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Spezialisierung: Template 2.16.840.1.113883.10.12.201 CDA Section (2005‑09‑07) ref ad1bbr- | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Verabreichte Medikation während des Aufenthalts
| Id | 1.2.276.0.76.10.3030 | Gültigkeit | 2013‑12‑30 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | Medicationduringstaysection | Bezeichnung | Verabreichte Medikation während des Aufenthalts | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beschreibung | Sämtliche verabreichte Medikation während des Aufenthalts | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Section level template | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Spezialisierung: Template 2.16.840.1.113883.10.12.201 CDA Section (2005‑09‑07) ref ad1bbr- | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Medikation bei Entlassung
| Id | 1.2.276.0.76.10.3031 | Gültigkeit | 2013‑12‑30 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | Dischargemedicationsection | Bezeichnung | Medikation bei Entlassung | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beschreibung | Medikation bei Entlassung | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Section level template | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Spezialisierung: Template 2.16.840.1.113883.10.12.201 CDA Section (2005‑09‑07) ref ad1bbr- | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Section: Prozeduren und Maßnahmen
In dem Abschnitt Prozeduren und Maßnahmen werden u. a.
- Fachspezifische Eingriffe
- Operationen
- Strahlentherapie
- Lichttherapie
- Psychiatrische Therapie
abgebildet.
Damit ist die Weitergabe von Freitextprozeduren oder Prozeduren ohne OPS möglich.
| Id | 1.2.276.0.76.10.3032 | Gültigkeit | 2013‑12‑30 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | Proceduressection | Bezeichnung | Prozeduren und Maßnahmen | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beschreibung | Kurzbeschreibung sämtlicher während des Aufenthalts durch-geführten Maßnahmen, wie OPs, Eingriffe oder sonstige Maßnahmen. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Section level template | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Spezialisierung: Template 2.16.840.1.113883.10.12.201 CDA Section (2005‑09‑07) ref ad1bbr- | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Section: Epikrise (Zusammenfassung des Aufenthalts)
| Id | 1.2.276.0.76.10.3021 | Gültigkeit | 2013‑09‑16 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | Hospitalcoursesection | Bezeichnung | Zusammenfassung des Aufenthalts | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Section level template | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Adaptation: Template 1.3.6.1.4.1.19376.1.5.3.1.3.5 Hospital Course Section (DYNAMIC) ref bccdapilot- Spezialisierung: Template 2.16.840.1.113883.10.12.201 CDA Section (2005‑09‑07) ref ad1bbr- | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beispiel |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Section: Weitere empfohlene Maßnahmen
| Id | 1.2.276.0.76.10.3033 | Gültigkeit | 2013‑12‑30 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | Planofcaresection | Bezeichnung | Weitere empfohlene Maßnahmen | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beschreibung | Empfehlung für weitere noch durchzuführende Maßnahmen | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Section level template | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Spezialisierung: Template 2.16.840.1.113883.10.12.201 CDA Section (2005‑09‑07) ref ad1bbr- | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Section: Abschließende Bemerkungen (Schlusstext)
| Id | 1.2.276.0.76.10.3034 | Gültigkeit | 2013‑12‑30 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | Finalremarkssection | Bezeichnung | Abschließende Bemerkungen | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beschreibung | Ein am Ende des Briefes formulierter Freitext entsprechend einer Grußformel, z.B.: "mit kollegialen Grüßen | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Section level template | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Spezialisierung: Template 2.16.840.1.113883.10.12.201 CDA Section (2005‑09‑07) ref ad1bbr- | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Anmerkung: LOINC Codes mit einem vorangestellten X, wie hier X-FINREM, werden kurzfristig durch tatsächliche numerische LOINC Codes ersetzt. |
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Section: Anhang (Beilagen)
| Id | 1.2.276.0.76.10.3037 | Gültigkeit | 2014‑08‑25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | Beilagen | Bezeichnung | Beilagen/Anhang | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kontext | Elternknoten des Template-Element mit Id 1.2.276.0.76.10.3037 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Section level template | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Benutzt |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beziehung | Spezialisierung: Template 2.16.840.1.113883.10.12.201 CDA Section (2005‑09‑07) ref ad1bbr- | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beispiel |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Anmerkung: LOINC Codes mit einem vorangestellten X, wie hier X-OBSMED, werden kurzfristig durch tatsächliche numerische LOINC Codes ersetzt. |
Entry-Level-Templates für den Arztbrief (normativ)
Entry: Eingebettetes Objekt Entry (Template)
| Id | 1.2.276.0.76.10.4014 | Gültigkeit | 2014‑08‑25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Status | Versions-Label | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name | EingebettetesObjektEntry | Bezeichnung | Eingebettetes Objekt Entry | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kontext | Elternknoten des Template-Element mit Id 1.2.276.0.76.10.4014 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klassifikation | CDA Entry Level Template | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Offen/Geschlossen | Offen (auch andere als die definierten Elemente sind erlaubt) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Beispiel |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Entry-Level-Templates für den Arztbrief (informativ)
Die folgenden Entries sind im Entwurf vorhanden bzw. aus früheren Spezifikationen angelegt und werden hier der Vollständigkeit halber zur Information (nicht-normativ) gelistet:
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Umsetzungsstufen der Aktenkommunikation
Das Technical Framework von IHE ITI definiert wie Primärsysteme Patienteninformationen über die IHE XDS Schnittstellen einrichtungsübergreifend austauschen können. Die Patienteninformationen können dabei in unterschiedlichen Formaten und divergierender Granularität vorliegen. Die folgenden Abschnitte zeigen sechs Umsetzungsstufen für den Arztbrief auf. Die jeweiligen Umsetzungsstufen adressieren dabei unterschiedliche Standardisierungs- sowie Granularitätsgrade. Die einzelnen Umsetzungsstufen schließen sich gegenseitig nicht aus, sondern können parallel (oder nacheinander) umgesetzt werden. Im Sinne einer hohen Auswertbarkeit von medizinischen Daten ist die Migration auf höchster Umsetzungsstufe anzustreben.
Die Vermischung von verschiedenen Umsetzungsstufen innerhalb eines Dokumentes ist ebenso denkbar. Somit ist ein Dokument durch die verschiedenen Kombinationen von section- und entry-Level-Templates beliebig zu kombinieren. Siehe Grafik.
Beispiel: Wenn ein Arztbrief hauptsächlich Section Level Informationen beinhaltet, können dennoch Sektionen enthalten sein, die auch Entry Level Diagnosen abbilden.
[Abbildung 16] Integrationsstufen für CDA
Umsetzungsstufe 1: Austausch proprietärer Dokumente
In der ersten Umsetzungsstufe werden proprietäre Daten (z.B. Arztbriefe in PDF oder auch WORD) über die IHE Schnittstellen ausgetauscht. Die benötigten IHE XDS Metadaten für die Document Registry werden entweder manuell erfasst oder im Idealfall aus dem System automatisch extrahiert. Diese Umsetzungsstufe wird bereits jetzt von allen Primärsystemen, die IHE XDS Schnittstellen umsetzen, unterstützt. Die Auswertbarkeit der Dokumente beschränkt sich hier auf die angegebenen IHE XDS Metadaten.
Damit wird aber noch keinerlei Information in CDA-Strukturen ausgedrückt.
Umsetzungsstufe 2: Austausch CDA Level 1(a) Dokumente
In dieser Umsetzungsstufe werden proprietäre Dokumente (z. B. Arztbrief als PDF) als CDA Level 1 Dokument über die IHE Schnittstellen der elektronischen Akte ausgetauscht. Die zur Registrierung benötigten IHE XDS Metadaten können automatisch aus dem CDA Header extrahiert werden. Ein CDA Level 1 Dokument ist ein Dokument welches einen strukturierten CDA Header umfasst. Die eigentliche medizinische Information wird entweder Base 64 Encoded in den CDA Body eingefügt (manchmal als Level 1a bezeichnet). Diese Umsetzungsstufe setzt voraus, dass Primärsysteme in der Lage sind ein proprietäres Dokument mit einem CDA Header zu versehen.
Die Auswertbarkeit der Dokumente beschränkt sich hier auf die angegebenen IHE XDS Metadaten und den strukturierten CDA Header Informationen. (Diese Möglichkeit gilt für alle weiteren Umsetzungsstufen.) In Abbildung 3 wird dies durch den grauen Bereich symbolisiert.
Umsetzungsstufe 3: Austausch CDA Level 1(b) Dokumente
In dieser Umsetzungsstufe werden die medizinischen Informationen in einem CDA Level 1 Dokument ausgetauscht. Hierbei wird zwar jegliche Information in einzelnen Abschnitten in XML-Darstellung repräsentiert, allerdings nur in rein textueller Form.
Umsetzungsstufe 4: Austausch CDA Level 2 Dokumente
In dieser Umsetzungsstufe werden die medizinischen Informationen in einem CDA Level 2 Dokument ausgetauscht. Die medizinischen Informationen werden in semantisch beschriebenen Abschnitten vorgehalten und diese Abschnitte sind über eine Kodierung erkennbar.
Diese Umsetzungsstufe setzt voraus, dass Primärsysteme in der Lage sind CDA Level 2 Dokumente zu erzeugen. Die CDA Level 2 Dokumente können geparst werden und es kann eine Auswertung bis hin zu Abschnittsebenen von Dokumenten durchgeführt werden.
Wünschenswert ist die Umsetzung in Form von Section Level Templates, d.h. die Abschnitte befolgen konkrete Vorgaben bzgl. der Inhalte.
Umsetzungsstufe 5: Austausch CDA Level 3 Dokumente
In dieser Umsetzungsstufe werden die medizinischen Informationen in einem CDA Level 3 Dokument ausgetauscht. Die medizinischen Informationen werden in strukturierten und semantisch beschriebenen Abschnitten (Section Level Templates) als strukturierte granulare Informationen vorgehalten (Entry Level Templates). Ein CDA Dokument in dieser Umsetzungsstufe bildet klinische Dokumente/aggregierte Informationen, wie sie aktuell in Primärsystemen vorliegen, feingranular strukturiert ab. Die CDA Level 3 Dokumente können geparst werden und es kann eine Auswertung bis hin zu den in den einzelnen CDA Level 3 Dokumenten dokumentierten granularen Informationen durchgeführt werden.
Zusammenstellung von Informationen in CDA-Dokumenten
Die CDA-Struktur kann benutzt werden, um verschiedene Arten von Informationen zusammenzustellen. Zum einen ist es möglich, unterschiedlichste Abschnitte zu benutzen, um bspw. einen Arztbrief mit Anrede, Fragestellung, Diagnosen, Befunden, etc. zu erzeugen. Genauso ist es möglich, einige wenige Abschnitte zu benutzen, um bspw. nur einen Kumulativbefund für Laborwerte zu erstellen. Genauso ist es dann auch möglich, in einem CDA-Dokument lediglich einen einzigen Abschnitt mit bspw. einer Diagnose oder einer Maßnahme unterzubringen. Man unterscheidet hier also zwischen aggegregierten und feingranularen Informationen.
Ein CDA Level 3 Dokument muss nicht zwangsweise ein klinisches Dokument/aggregierte Informationen abbilden. Es kann auch einzelne granulare Informationen beinhalten (z. B. eine Diagnose), die über Referenzen zu einem klinischen Dokument aggregiert werden können.
Beispiel: ein CDA Level 3 Dokument mit dem Dokumententyp „Diagnose“ umfasst eine Diagnose. Dieses CDA Level 3 „Diagnose“ kann einem CDA Level 3 Dokument mit dem Dokumententyp „Arztbrief“ zugeordnet sein.
Der Ansatz auch feingranulare Informationen als strukturiertes Dokument (bspw. über die IHE XDS Schnittstellen) zu übermitteln bietet folgende Möglichkeiten: Sowohl strukturierte und unstrukturierte Informationen werden über einheitliche Schnittstellen ausgetauscht. Dies reduziert die Schnittstellenkomplexität und verringert die Einstiegshürde, da viele Systemhersteller bereits den etablierten IHE XDS Standard umsetzen. Die Wahl der generischen IHE XDS Schnittstellen begünstigen zudem die Beständigkeit der Schnittstellen und bieten den Systemherstellern Investitionssicherheit. Die Granularität der Auswertung hängt von der Umsetzungsstufe ab und ist auch sehr feingranular möglich.
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Terminologien
Value Sets
- AdministrativeGender (HL7) 2.16.840.1.113883.1.11.1
- ObservationInterpretation (HL7) 2.16.840.1.113883.1.11.78
- MaritalStatus 2.16.840.1.113883.1.11.12212
- ActStatus (HL7) 2.16.840.1.113883.1.11.15933
- SeverityObservation 2.16.840.1.113883.1.11.16643
- Basic Confidentiality Kind (HL7) 2.16.840.1.113883.1.11.16926
Kodesysteme
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Anhang
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Beschreibung der Use Cases und Storyboards
Ein CDA Dokument, und ein Arztbrief im speziellen, kann in der realen Implementierung auf unterschiedliche Art und Weise kommuniziert werden. Die hierbei eingesetzten Softwarekomponenten agieren, je nach Leistungsumfang der kommunizierenden Partnersysteme, in unterschiedlichen Rollen, so genannten Akteuren. Für die Überleitung dieser Praxis in eine detailliertere Beschreibung werden sogenannte Use Cases und Storyboards, die eine Situation aus der Anwendersicht beschreiben, in eine mehr technische Darstellung, dem Interaktionsmodell, überführt. Es werden die häufigsten Use Cases beschrieben: der vollständige Arztbrief, die Änderung eines Arztbriefes und das Anhängen von weiteren Dokumenten und Objekten.
Use Case: Vollständiger Arztbrief („Alles ist da")
Der vollständige Arztbrief, d. h. alle relevanten medizinischen und demographischen Daten sind verfügbar, ist aus IT-Sicht der einfachste Fall. Der Arztbrief kann mit allen Inhalten und Referenzen in einem Arbeitsgang
- erstellt
- freigegeben und
- versendet werden.
Es steht dem Autor frei, unabhängig vom klinischen „Fall", die aus seiner Sicht zusammengehörigen medizinischen Ereignisse zu einem Patienten in einem Arztbrief zusammenzustellen. Ein Arztbrief bezieht sich somit auf exakt einen Patienten und auf eine „Episode" medizinischer Aktivitäten, womit das Konzept des HL7-Encounter gemeint ist, nämlich eine - aus der Sicht des Autors - zeitlich und logisch zusammengehörige Menge medizinischer Ereignisse. Eine Episode kann einem klinischen „Fall" entsprechen, kann aber auch mehrere „Fälle" ganz oder in Teilen oder umgekehrt nur Teilaspekte eines „Falls" beschreiben. Vor der Freigabe kann ein Arztbrief nicht versendet werden; diese Freigabe kann allerdings auch implizit durch das Versenden erfolgen. Einmal freigegeben, kann der Inhalt des Dokuments nicht mehr verändert werden; jedoch kann eine neue Version mit Bezug auf das Original erzeugt werden. Die Freigabe bezieht sich nicht auf den Inhalt eingebundener Dokumente, da diese zuvor unabhängig freigegeben wurden. Diese Schritte können, aber müssen nicht notwendigerweise zeitnah durchgeführt werden.
Storyboard: Vollständiger Arztbrief (POCD_SN000001DE)
Herr Paul Pappel, geboren am 17.12.1955 in Düsseldorf, wohnhaft Riedemannweg 59, 13627 Berlin soll am 30.06.2005 von der Inneren II der Heliosklinik Berlin Buch entlassen werden. Er befand sich seit dem 25.05.2005 in stationärer Behandlung.
Die Aufnahmediagnose lautete: Verdacht auf Lungenemphysem (J43.9 A).
Stationsarzt Dr. Müller geht am Vorabend der Entlassung an sein KIS-System und lässt sich eine Liste der am Folgetag zur Entlassung anstehenden Patienten anzeigen. Er ergänzt alle fehlenden Einträge in der Krankengeschichte und diktiert für den weiterbehandelnden Allergologen Dr. Schiwago und nachrichtlich an den Hausarzt Dr. No einen Entlassbrief mit den folgenden Inhalten:
Anamnese:
Seit Jahren wiederholt chronische Bronchitiden besonders bei kalter Luft. Bei Anstrengung exspiratorische Atemnot. Kontakt mit Haustieren.
Befund:
Pricktest:
| Birke +++ | Gräser-Mix +++ | Hausstaubmilbe 1 + |
| Haselstrauch +++ | Kammgras ++ | Hausstaubmilbe 2 + |
| Erle + | Roggen ++ | Schafwolle + |
| Hainbuche + | Quecke + | Rotbuche + |
| Eiche + | ||
| Keine Reaktion auf weitere Pollen, Katzen- / Hundehaare, Schimmelpilz. | ||
Pulmo: Basal diskrete RGs
Cor: oB
Abdomen: weich, Peristalik+++
Muskulatur: atrophisch
Mundhöhle: Soor, Haarleukoplakie
Haut blass, seborrhoisches, Ekzem. Schleimhäute blass, Hautturgor herabgesetzt.
Neuro: herabgesetztes Vibrationsempfinden der Beine, distal betont. Parästhesien der Beine, PSR, ASR oB und seitengleich.
Diagnosen:
| J45.0 | G | Allergisches Bronchialasthma |
| J43.9 | A | Ausgeschlossen: Lungenemphysem |
| J31.1 | V | Verdacht auf Allergische Rhinopathie durch Pollen |
Laborparameter:
| Methode | Normbereich | 25.06.05 | 26.06.05 | 28.06.05 | 29.06.05 | Einheit |
| HB | 13.5-16.5 | 12.7 | 13.3 | 13.6 | 11.9 | g/dl |
| THRO | 150-400 | 147 | 250 | 325 | 215 | 10*9/l |
| LEUKO | 4-9.4 | 7.98 | 8.34 | 7.47 | 4.56 | 10*9/l |
| CD4_ABS | 500-1000 | 30 | %/ul | |||
| AMYL | 6-34 | 40 | U/l | |||
| G-GT | 5-28 | 14 | 21 | U/l |
Röntgen:
- 26.05.2005: Röntgen Thorax: o.B.
Fremdbefunde: -
Histologie: -
Verlauf: -
Entlassungsbefund:
|Intensiviert behandlungsbedürftiges Bronchialasthma. Ich habe mit dem Patienten besprochen, zunächst die Peakflow-Werte zu optimieren und das Beschwerdebild zu beobachten.
Prognose: -
Therapien:
- Atemur, morgens 2x und abends 2x
Empfehlung: Sollten nach der empfohlenen Medikation mit Atemur die klinischen Zeichen weiterhin bestehen, halte ich bei dem umfangreichen Risikoprofil einen Kuraufenthalt für zwingend erforderlich. Ich bitte dann um Wiedervorstellung des Patienten.
Storyboard: Arztbrief vom Hausarzt (POCD_SN000007DE)
Diese Situation entspricht einem Brief vom Hausarzt.
CAVE:
ULCUSKRANKHEIT, Allergie auf DoloPosterine, AMOXICILLIN
Anamnese:
- Übliche Kinderkrankheiten, in der Kindheit Nierenerkrankung (?), sonst in früheren Jahren keine wesentlichen Vorerkrankungen.
- 1955 Appendektomie
- 1956 TE
- 1968 OP einer Pericardcyste
- Seit 1989 Hypertonie und latente Hypothyreose.
- 1989 Ulcus duodeni.
- 1977 und 1993 Polypektomie im Colon deszendens, Kontroll-Coloskopie 3/99 o. B.
- 11/01 kleiner Mediateilinfarkt re. unklarer Ätiologie.
- Seit Jahren Descensus uteri et vaginae.
- Hallux valgus li.
- Patelladysplasie Typ Wibert II. li.
- 6/02 Arthroskopie re. Knie.
- 9/03 Koloskopie mit Resektion eines Polypen im Colon ascendens.
- 1/2005 ED eines Bandscheibenprolaps L3/4 und einer Spinalkanalstenose L4/5.
- 5/2005 distale Radiusfraktur li. mit distaler Ulnafraktur. Versorgung mittels Platte und K-Draht.
- Seit 11/2005 manifester Diabetes mellitus Typ II.
- 9/2006 Polypektomie Colon deszendens, sonst Koloskopie o. B.
- 12/2008 Kontrollcoronarangiographie ohne akut interventionsbedürftigen Befund.
- 1/2010 Kontrollkoloskopie, Abtragung von zwei Polypenknospen.
- 04/2011 OP bei hochgradiger Spinalkanalstenose abgelehnt
- 5/2011 therapeutische LA lumbal erfolgreich
- 8/2011 mikrochirurgische Erweiterung WK LWK 1/2 bis 4/5.
- 11/2011 NPP L4/5: konservativ.
- 12/2011 Distorsion OSG re.
- 1/2012 vaginale Hysterektomie bei Uterus myomatosus.
- 3/2012 ED einer mittelschweren Coxarthrose re.
- 06/2012 bei initialem V. a. dementielle Entwicklung Ausschluss NPH oder cerebale Raumforderung (CT).
- 9/2012 erneute Nukleotomie mit Spondylodese L4/5
Dauerdiagnosen:
- Diabetes mellitus – gesichert –
- Depressive Episode
- Hypertonie
- Nicht näher bezeichnete Hämaturie
- Lumboischialgie
- Zust. nach Hirninfarkt nicht näher bezeichnet re.
- Hypothyreose nicht näher bezeichnet
- Koronare Herzkrankheit
- Jodmangelbedingte mehrknotige Struma endemisch
- Chronisches Schmerzsyndrom
- Spinalkanalstenose: Lumbalbereich
- Varicosis bds.
- Sonstige sekundäre Koxarthrose re.
- Drop Attacks
Dauermedikation
| Morgens | Mittags | Abends | zur Nacht | |
|---|---|---|---|---|
| Bisoprolol | 1 | |||
| ASS 100 | 1 | |||
| Allopurinol 300 | 1 | |||
| Amitriptylin 75 | 1 | |||
| Jodid 200 | 1 | |||
| Simvastatin 40 | ½ |
Letzte Änderung am: 13.11.2012
Kontrolluntersuch
HZV-DAK
DMP Diabetes mellitus
Impfungen:
| Datum | Art | Chargennummer |
|---|---|---|
| 19.2.13 | Td-pur Impfung (Tetanol/Diphterie). | 063311A (D) |
| 8.11.02 | Pneumopur i.m. | HP27610 (D) |
| 24.3.00 | 2. Havrix 1440 i.m. | VHA604C6 (St) |
| 23.9.99 | 1. Havrix 1440 i.m. | VHA551B6 |
Use Case: Nachtragen / Anhängen weiterer Information, Ersetzen eines vorläufigen Arztbriefs
Ausgangssituation: Der Arztbrief wurde bereits vorher in Teilen erstellt und versendet (vorläufiger Arztbrief), jedoch fehlten bislang einige Informationen, wie zum Beispiel Diagnosen oder Befunde. Der ursprüngliche Arztbrief war also deswegen als „vorläufig" gekennzeichnet, jedoch so bereits freigegeben und wurde als Vorgängerversion schon versendet.
Sobald die bisher fehlende Information vorliegt, kann der „vorläufige" Arztbrief im Rahmen einer neuen Version ergänzt, freigegeben und als Ganzes erneut versendet werden. Diese Dokumentenbeziehung wird in CDA Release 2 als „replacement" bezeichnet. Es entsteht also ein neues Dokument, das an den "vorläufigen" Arztbrief durch eine replacement-Beziehung angehängt ist.
Beim Empfänger ist der Bezug des vollständigen Arztbriefs zum vorherigen erkennbar, es handelt sich jedoch um zwei Dokumente mit unterschiedlicher Identität.
Storyboard: Revision Arztbrief Teil 1 (POCD_SN000002DE)
Im ersten Schritt kommt dieses Storyboard der Übersendung eines vorläufigen Arztbriefes gleich. Am Tag der Entlassung von Frau Emma Erle, 30 Jahre, stellt Dr. Maier fest, dass die Ergebnisse der letzten Laboruntersuchung noch nicht vorliegen. Da er dennoch zeitgleich mit der Entlassung einen Arztbrief an Dr. Schulze, dem Hausarzt von Frau Erle, schicken möchte, entscheidet er sich, in seinem IT-System einen "vorläufigen Arztbrief" zu erstellen. Dr. Maier wählt hierzu aus den ihm vorliegenden klinischen Befunden alle ihm relevant erscheinenden Informationen aus. Die Diagnosen übernimmt er inklusiv der in seinem System vorgenommenen Kodierungen direkt in den Arztbrief. Den OP-Bericht kürzt er und streicht alle Informationen, die ihm für die Weiterbehandlung nicht relevant erscheinen, die CT-Befunde ergänzt er dagegen um eine zusätzliche Interpretation. Anstelle der noch ausstehenden Laborbefunde fügt er einen entsprechenden Vermerk und sendet den vorläufigen Arztbrief an Dr. Schulze.
Anamnese:
Seit der Geburt ihres Kindes vor 5 Monaten klagte die Patientin über Schmerzen im LWS-Bereich mit Ausstrahlung in das rechte Bein bis hin zur Großzehe. Eine konservative ambulante Therapie habe bisher keinen Erfolg gebracht. Die allgemeine Vorgeschichte ist unauffällig.
Befund:
Bei der Untersuchung zeigte die Patientin eine aufrechte Haltung, sowie einen zügigen, sicheren und koordinierten Gang, ohne Gehhilfsmittel. Ein leicht schmerzbetontes Hinken bei Vollbelastung beider Beine war rechtsseitig zu beobachten.
Die WS ist gerade aufgebaut, bei einer deutlichen Hyperlordose der LWS. Die paravertebrale Rumpfmuskulatur war beidseitig kräftig entwickelt. Ein Druck- oder Klopfschmerz war nicht auszulösen. Der Zehenspitzen- und Hackengang war beidseitig normal durchführbar, ebenso wie der Einbeinstand beidseits. Die Seitwärtsneigung nach rechts war endgradig schmerzhaft, nach links unauffällig durchführbar und die Rotation beidseitig unauffällig möglich. Die Reklination war ohne Schmerzen durchzuführen, die Inklination jedoch deutlich mit Schmerzen verbunden, der FBA reichte bis zu den Kniegelenken. Das Laseguèsche Phänomen war rechts bei 60° positiv, links endgradig positiv. Der PSR war beidseits seitengleich, ebenso der ASR seitengleich und normal auslösbar.
Sensibilitätsstörungen fanden sich nicht, ebenso wenig motorische Störungen. Die Beweglichkeit der unteren Extremitätengelenke war in allen Ebenen frei möglich und die Beinlänge seitengleich.
Diagnosen:
M51.3+G51.1* G L: Wurzelkompression S1 durch subligamentär sequestrierten BSV parasacral li. Laborparameter: Folgen noch!
Röntgen:
Kernspintomographie der LWS:
1. Im Segment L4/5 mäßige Höhenminderung des Zwischenraums mit Signalabsenkung innerhalb des Bandscheibengewebes als Zeichen der Degeneration.
Es resultiert eine tropfenförmige, noch subligamentär situierte Bandscheibenherniation, die zu einer ovalären Impression des Duralsacks führt. Die intraformalinaren Nervenwurzeln kommen symmetrisch regelrecht zur Darstellung.
2. Im Segment L4/S1 ebenfalls Signalabsenkung innerhalb des Bandscheibengewebes, bei noch erhaltener Höhe des Zwischenwirbelraums: Dehydralation des Nucleus pulposo. Schmale kragenförmige Protrusion mit angedeuteter Parottierung des Duralsacks.
3. In L 3/4 „bulging disc"
4. In den übrigen Etagen keine Besonderheiten
Fremdbefunde: -
Histologie: -
Verlauf: -
Entlassungsbefund:
Keine sensomotorischen Ausfälle
Prognose: -
Therapien:
OP am 20.12.2005: Nach Einleitung der Intubationsnarkose Lagerung der Patientin in Bauchlage und Kniehockstellung. Palpatorische Höhenlokalisation über den Dornfortsätzen von LWK 5 / SW 1 von links und Anlage eines medialen Hautschnittes. Präparation der subkutanen Fettschicht, Darstellung der muskulären Fascie. lncision derselben und Abschieben der langen Rückenmuskulatur vom medialen Fascienblatt nach lateral. Nochmals Überprüfung der korrekten Höhe. Nachcaudal lässt sich kein weiteres interlaminäres Fenster mehr tasten. Nach Einsetzen des selbsthaltenden Williamssperre erfolgt unter Zuhilfenahme des Operationsmikroskopes die erweiterte interlaminäre Fensterung. Intraspinal findet sich epidurales Fettgewebe, nach vorsichtiger Präparation und Darstellung der nach dorso-medial deutlich verlagerten komprimierten Nervenwurzel stellt sich in Höhe des Bandscheibenraumes ein großer, breitbasiger subligamentär sequestrierter Bandscheibenvorfall dar. Nach vorsichtiger Medialisierung der nervalen Strukturen und nochmals Erweiterung der interlaminären Fensterung scharfe lncision des hinteren Längsbandes. Es lässt sich ein sequestierter Bandscheibenvorfall problemlos entfernen. Danach sind die nervalen Strukturen bereits deutlich entspannt, jetzt Eingehen in den dazugehörigen Bandscheibenraum. Es erfolgt die Nukleotomie. Es lässt sich jede Menge degenerativ verändertes Bandscheibengewebe entfernen. Von medio-caudal her findet sich noch subligamentär ein weiterer kleinerer Bandscheibensequester. Nach kranial hin scheint das hintere Längsband angehoben, es lässt sich jedoch auch von medio-caudal her vom festen Osteosacrum eine kleine osteochondrotische Randzacke tasten. Diese kann teilweise auch entfernt werden. Nach mehrmals Spülen mit physiologischer Kochsalzlösung finden sich keine freien Bandscheibensequestermaterialen mehr. Nochmals Darstellung der freien nervalen Strukturen mit Hilfe des gebogenen Dissektors. Anschließend kann die Operation beendet werden durch schichtweisen Wundverschluss, Muskelfasciennaht, Subcutannaht, lntracutannaht. Steriler Verband.
Empfehlung:
Um die Rumpfmuskulatur nach der OP zu stärken, die Haltung zu verbessern und weiteren Beschwerden vorzubeugen empfehlen wir krankengymnastische und muskelkräftigende Übungen in Einzeltherapie, eine Haltungsschulung, Bewegungsbäder, Rückenschwimmen, Fango und Massage für die LWS, aussparend den S1-Bereich, sowie Massagen für Schulter- und Nackenbereich.
Storyboard: Revision Arztbrief Teil 2 (POCD_SN000003DE)
Dr. Schulze erhält den vorläufigen Arztbrief über den Krankenhausaufenthalt seiner Patientin Emma Erle in seinem Eingangsordner. Er erkennt sofort, dass es sich um eine vorläufige und damit unvollständige Version handelt. Dennoch verschafft er sich einen ersten Überblick über die Krankheitssituation von Frau Erle. 3 Tage später erhält Dr. Maier einen Hinweis in seinem IT-System, dass neue Laborbefunde für Frau Erle vorliegen.
Laborparameter:
Der CHOL-Wert war mit 294 mg% leicht erhöht, sowie die BSG mit 18/42 leicht erhöht. Normalwertig waren rotes und weißes Blutbild, harnpfl. Substanzen, Transamiasen, LDH, GGT, TG, RF, CRP, ASL, Elektrolyte, BZ-nüchtern und der Quick-Wert. In Urinsediment fanden sich 70-80 Leucos.
Er ruft den vorläufigen Arztbrief für Frau Erle auf und erzeugt eine neue, revidierte Version, in die alle Informationen aus dem vorläufigen Arztbrief 1:1 übernommen werden. Zusätzlich wird eine entsprechende Referenz auf die Vorgängerversion in den Arztbrief eingefügt. Anschließend löscht Dr. Maier den Vermerk über die fehlenden Laborwerte und ersetzt sie durch eine Zusammenfassung der wichtigsten Laborergebnisse sowie eine Kommentierung dieser Parameter. Vor dem Absenden ändert Dr. Maier noch den Typ des Arztbriefes von "vorläufiger Arztbrief" auf "endgültiger Entlassbrief" und schickt eine zusätzliche Kopie an Frau Erle, da diese ihn darum gebeten hat, direkt über die endgültigen Ergebnisse informiert zu werden. Dr. Schulze erhält den endgültigen Entlassbrief in seinem Eingangsordner. Da die Vorgängerversion bekannt und bereits in seinem IT-System abgelegt ist, kann er einen Abgleich zwischen beiden Versionen durchführen und sich die neuen Änderungen in der aktuellen Version graphisch hervorgehoben anzeigen lassen. Da er den vorläufigen Arztbrief bereits gelesen hat, überfliegt Dr. Schulze nur noch die geänderten Abschnitte und hat nun ein klares Bild über den gesamten Klinikaufenthalt Frau Erle.
Use Case: Referenzieren von Arztbriefen (Einbinden)
Ein bestehender, bereits freigegebener Arztbrief wird in einen in Erstellung befindlichen zweiten Arztbrief durch Referenzierung eingebunden. Der referenzierte Arztbrief selbst bleibt dabei unverändert. In beiden Arztbriefen wird auf denselben Patienten Bezug genommen. Die Autoren und Empfänger der beiden Arztbriefe sind typischerweise verschieden.
Storyboard: Referenzierung im Arztbrief Teil 1 (POCD_SN000004DE)
Im ersten Schritt kommt dieses Storyboard der Übersendung eines Kurzarztbriefes (in diesem Falle Informationen bei Überweisung) gleich. Der Hausarzt Dr. Huber überweist seine Patientin Birgit Birke an einen Facharzt der Dermatologie mit der Verdachtsdiagnose eines subkutanen Melanoms am Übergang Hinterkopf Hals. Der Dermatologe erhält vom Hausarzt einen Kurzarztbrief mit Medikation (Penicillin, Insulin), Anamnese und Diagnose (Borreliose, eine Woche zuvor) etc.
Anamnese:
Die 63 jährige insulinpflichtige Diabetikerin stellt sich im Rahmen einer Borliosebehandlung mit einer Hautveränderung am Übergang zwischen Hinterkopf und Hals vor. Nach Aussage der Patientin soll sie sich innerhalb der letzten 3 Monate gebildet haben.
Befund:
20.12.2005: Oberflächlich spreitende, unregelmäßige, Hautveränderung am Übergang vom Hinterkopf zum Hals mit einem Durchmesser von ca. 1 cm, Unregelmäßige, überwiegend dunkle Hautverfärbung. Verhärtet.
Diagnosen:
E11.90 G Nicht primär insulinabhängiger Diabetes mellitus (Typ-2-Diabetes) ohne Komplikationen, nicht als entgleist bezeichnet
A69.2 G Borreliose
C43.4 V Verdacht auf Melanom am Übergang vom Hinterkopf zum Hals
Laborparameter: -
Röntgen: -
Fremdbefunde: -
Histologie: -
Verlauf: -
Entlassungsbefund: -
Prognose: -
Therapien:
Huminsulin Basal (NPH) Fertigpen 3 ml, morgens und abends, je eine Spritze Penicillin V1 Mega von ct, morgens, mittags und abends, je eine Filmtablette
Empfehlung: -
Storyboard: Referenzierung im Arztbrief Teil 2 (POCD_SN000005DE)
Im zweiten Schritt kommt dieses Storyboard der Übersendung eines weiteren Kurzarztbriefes (in diesem Falle Informationen bei Überweisung) mit angehängtem Arztbrief gleich.
Der Dermatologe untersucht die Patientin und fertigt zusätzlich ein Bild der fraglichen Region an, die rötlich gefärbt ist. Er kommt zu der Entscheidung, dass eine Entfernung der Wucherung ambulant/stationär im Krankenhaus erfolgen soll und weist die Patientin ins Marienhospital ein.
Dabei übersendet er dem Krankenhaus seinen Arztbrief mit Bild und hängt den Kurzarztbrief des Hausarztes an. Zusätzlich sendet der Dermatologe dem Hausarzt eine Kopie des Briefes.
Anamnese:
Siehe Arztbrief des Hausarztes in der Anlage
Befund:
21.12.2005: Oberflächlich spreitende Hautveränderung am Übergang vom Hinterkopf zum Hals mit einem Durchmesser von 1 cm.
Diagnosen:
C43.4 V Verdacht auf Melanom am Übergang vom Hinterkopf zum Hals Laborparameter: -
Röntgen: -
Fremdbefunde: -
Histologie: -
Verlauf: -
Entlassungsbefund: -
Prognose: -
Therapien: -
Empfehlung: Ambulantes oder stationäres Entfernen der Hautveränderung und histologische Bestimmung.
Storyboard: Referenzierung im Arztbrief Teil 3 (POCD_SN000006DE)
Diese Situation entspricht einem Entlassbrief mit angehängten Arztbriefen.
Im Krankenhaus wird vor dem operativen Eingriff zur Abklärung der Beteiligung des Schädelknochens eine Röntgenaufnahme gefertigt und anschließend die gutartige Wucherung ambulant entfernt. Auf Wunsch der Patientin wird diese zur Nachbehandlung an den Hausarzt überwiesen.
Dabei wird ein Entlassbrief zur Nachbehandlung für den Hausarzt erzeugt. Am Entlassbrief ist der Arztbrief des Dermatologen angehängt. Der Dermatologe erhält eine Kopie.
Anamnese:
bekannt
Befund:
28.12.2005: Unklarer Befund bei Abdomensonographie zur Detektion viszeraler Metastasen
Diagnosen:
C43.4 A Melanom D36.9 G Melanom, benigne
Laborparameter: -
Röntgen:
29.12.2005: Ein CT hat keinen Metastasenbefund ergeben.
Fremdbefunde: -
Histologie:
06.01.2006: Kein Hinweis auf ein malignes Melanom bei der eingesendeten Körpersubstanz.
Verlauf: -
Entlassungsbefund:
Bei der uns zum operativen Eingriff eingewiesenen Patientin konnte der Verdacht auf ein malignes Melanom ausgeschlossen werden. Die Patientin wurde darauf hingewiesen, bei weiteren Hautveränderungen sofort einen Arzt aufzusuchen.
Prognose: -
Therapien:
30.12.2005: Entfernung des Hautbereiches ohne Komplikationen, Einsendung zur histologischen Befundung.
Empfehlung:
Nachversorgung des Eingriffs mittels Heilsalbe mit Wirkstoff Panthenol nach Bedarf.
Anamnesekategorien
Anamnesen können in die folgenden Kategorien aufgeteilt werden:
| Angaben flach (ohne Substrukturen) | Angaben strukturiert (Stufe) | LOINC | Snomed CT |
|---|---|---|---|
| Eigenanamnese | 57041-6: Patient history and diagnoses | ||
| Allgemeine Anamnese | 10164-2: History of present illness | 417662000: past medical history | |
| Frühere Krankheiten | 11348-0 History of past illnesses 11338-1: History of major illnesses and injuries |
417662000: past medical history | |
| Frühere Operationen | 67803-7: History of procedures 10167-5: istory of surgical procedures |
161615003: surgery history | |
| Fachspezifische Anamnese | |||
| Psychosoziale Anamnese | 10165-9: History of psychiatric symptoms & diseases | 371585000: psychosocial assessment | |
| Familienanamnese | 54114-4: Family member health history 65947-4: Family history notes |
416471007: family medical history | |
| Fremdanamnese | |||
| Immunisierungen | 11369-6: History of immunization | 127785005: immunisation | |
| Allergien | 10155-0: History of allergies | ||
| Medikamentenanamnese | 101660-0: History of medication use | 394829006: past medication | |
| Schwangerschaften | 56833-7: Pregnancy related history | 289908002: pregnancy |
[Tabelle 9] Darstellung der Informationen zur Anamnese in flacher oder substrukturierter Form (mögliche Hierarchieandeutung über die Icons ![]() ), die Codes für die jeweiligen Abschnitte sind hier weggelassen. In der Praxis findet sich in der Regel bislang allein die flache Wiedergabe der Informationen.
), die Codes für die jeweiligen Abschnitte sind hier weggelassen. In der Praxis findet sich in der Regel bislang allein die flache Wiedergabe der Informationen.
Der Arztbrief in dieser Spezifikation behandelt zunächst nur die folgenden Kategorien (siehe auch Anamnesen):
- Jetzige Anamnese (LOINC 10164-2) 1.2.276.0.76.10.3022
- Frühere Erkrankungen (LOINC 11348-0) 1.2.276.0.76.10.3023
- Familienanamnese (LOINC 10157-6) 1.2.276.0.76.10.3024
Prinzipiell wäre sowohl eine Angabe der verschiedenen „Sub"-Kategorien flach als auch in hierarchischer Anordnung möglich. In der Praxis findet sich heutzutage noch meist die flache Struktur. Allerdings sind auch komplexere Dokumentationen vorhanden (die zunächst nicht Gegenstand dieser Spezifikation sind), wie zum Beispiel die Herzkatheder-Untersuchungsdokumentation die höher strukturiert (geschachtelt) ist.
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Beispiele von Gesamtdokumenten
Für alle Storyboards aus dem Abschnitt Use Cases und Storyboards findet sich in den XML-Materialien zum Arztbrief jeweils ein Beispieldokument.
Die vollständige Fassung eines Level 1 CDA-Beispiels mit einem PDF ist dort ebenfalls aufgenommen.
Die XML-Materialien mit den Beispieldokumenten können hier herunterladen werden.
Schemas, Schematronregeln
Zur Validierung der CDA-Dokumente empfehlen wir die Verwendung des Schemas und der Schematronregeln (Zwei-Stufen-Validierung). Diese befinden sich ebenfalls in de XML-Materialien auf der Dokumentationsseite von HL7 Deutschland.
Beispiel: Validierung eines CDA eArztbriefes mit einem XML-Editor
Zur Darstellung - das neue Stylesheet
Für den Arztbrief 2015 wurde ein neues Stylesheet entwickelt. Dieses kann hier heruntergeladen werden: Herunterladen
Beispiel für die Transformation eines CDA eArztbriefes mittels des Stylesheets
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Literatur und Referenzen
Weiterführende Literatur
Folgende Literatur ist zum Verständnis des Leitfadens hilfreich:
- "The CDA-Book", Keith Boone, Springer
- HL7 V3 Primer, Andrew Hinchley
- HL7 V3 Introduction
- HL7 Datentypleitfaden
- VHitG-Arztbrief, v1.0/2005, v1.5/2006
Glossar und Abkürzungsverzeichnis
Für ein Glossar der Begriffe wird auf die "Enzyklopädie des deutschen Gesundheitswesens" bei Interoperabilitätsforum verwiesen: http://wiki.hl7.de/index.php?title=Kategorie:Enzyklopädie
Das Interoperabilitätsforum führt auch ein Abkürzungsverzeichnis: http://wiki.hl7.de/index.php?title=Kategorie:Abkürzungen
Referenzen
- ↑ Abstimmungsverfahren (Regeln) des Interoperabilitätsforums http://wiki.hl7.de/index.php?title=Abstimmungsverfahren_(Regeln)
- ↑ HL7 Deutschland e. V. http://www.hl7.de
- ↑ 3,0 3,1 Erstellung von XML-Signaturen für Dokumente nach Clinical Documents Architecture – R2 (Elektronische Signatur von Arztbriefen). Spezifikation der Bundesärztekammer, Ärztekammer Nordrhein, Ärztekammer Westfalen-Lippe. Version 1.4 vom 20. Mai 2008
- ↑ IHE Deutschland: Cookbook http://wiki.hl7.de/index.php?title=IHE_DE_Cookbook
- ↑ Arztbrief des VHitG (jetzt bvitg), http://www.bvitg.de/arztbrief.html
- ↑ SCIPHOX GbR mbH Arbeitsgruppe, alte Materialien unter sciphox.hl7.de, insbesondere „Working draft 15“
- ↑ HL7 v3 , CDA Rel. 2 „ Implementation Guide for CDA Re-lease 2 – Level 1 and 2 – Care Record Summary (US realm)“, 2005-11-17, 3rd normative ballot
- ↑ Use Cases for Medical Summaries, L. McNight, IHE PCC, 2005-09-08
- ↑ Guide d’implémentation du Volet Médical au format CDA Re-lease 2 – Niveau 3, 2005-09-01
- ↑ e-MS. Clinical Document Architecture Implementation Guide Vancouver Island Health Authority, British Columbia (Level 2 und 3), 2004-12-17
- ↑ IHE Laboratory Technical Framework, Supplement „Sharing Laboratory Reports (XDS-LAB)“ vom 14. September 2006. http:// www.ihe.net
- ↑ ELGA-Spezifikationen http://elga.gov.at, nationale Infrastruktur Österreich
- ↑ HL7 v3 Clinical Document Architecture, Release 2.0 (ANSI Standard CDA Release 2, Juli 2005), ISO/HL7 27932:2009 Data Exchange Standards -- HL7 Clinical Document Architecture, Release 2
- ↑ World Wide Web Consortium. Extensible Markup Language, 1.0, 2nd Edition. http://www.w3.org/TR/REC-xml
- ↑ First international conference on CDA, Berlin 2002. Konfe-renz-Website und Proceedings http://www.hl7.de/cda2002
- ↑ Second International conference on CDA, Acapulco 2004. Konferenz-Website und Proceedings http://www.hl7.de/iamcda2004
- ↑ KBV. KBV Kassenärztliche Bundesvereinigung. [Online] 2013. [Zitat vom: 18. Juli 2013.] http://www.kbv.de/themen/12301.html
Abbildungen
- ↑ RIM Basisklassen
- ↑ CDA Modell mit Clinical Document Header, Body Structures und Entries
- ↑ Grober Aufbau eines CDA Dokuments
- ↑ Auswahlliste der CDA Body Entries
- ↑ Clinical Document Architecture Release 2.0 Modellübersicht
- ↑ Interaktionsdiagramm
- ↑ Clinical Document Klasse
- ↑ CDA nonXMLBody
- ↑ Übersicht über den Body-Teil des CDA-Dokuments
- ↑ CDA Level 1
- ↑ CDA Level 2
- ↑ CDA Level 3
- ↑ CDA Section Komponente mit Bestandteilen
- ↑ Tabellen-Beispiel in Browser-Ansicht
- ↑ ObservationMedia CDA Entry für Multimedia-Objekte
- ↑ Integrationsstufen für CDA