Pathologiebefund auf der Basis von CDA R2
Foemig (Diskussion | Beiträge) |
Foemig (Diskussion | Beiträge) K |
||
| Zeile 56: | Zeile 56: | ||
{{HL7transclude|cdapath:statisches Modell}} | {{HL7transclude|cdapath:statisches Modell}} | ||
{{HL7transclude|cdapath:Dokumenttypen}} | {{HL7transclude|cdapath:Dokumenttypen}} | ||
| + | |||
{{HL7transclude|cdapath:Header}} | {{HL7transclude|cdapath:Header}} | ||
| + | {{HL7transclude|cdapath:Patient (recordTarget) (Template)}} | ||
| + | {{HL7transclude|cdapath:Autor (author) (Template)}} | ||
| + | {{HL7transclude|cdapath:Verwaltende Organisation (custodian) (Template)}} | ||
| + | |||
{{HL7transclude|cdapath:Body}} | {{HL7transclude|cdapath:Body}} | ||
{{HL7transclude|cdapath:Anhänge}} | {{HL7transclude|cdapath:Anhänge}} | ||
Version vom 13. Februar 2013, 12:11 Uhr
|
|
Dieses Dokument gibt wieder:
Implementierungsleitfaden Pathologiebefund auf der Basis von CDA R2 (08). Die Teilmaterialien gehören der Kategorie cdapath an. |
HL7 Clinical Document Architecture Release 2
für das deutsche Gesundheitswesen
| Abstimmungsdokument | |||
|---|---|---|---|
| Version | Datum | Status | Realm |
| 08 | 2012 | ||
| noch kein download verfügbar | |||
| Kontributoren | ||
|---|---|---|
| Agfa HealthCare GmbH | Bonn | |

|
Vivantes Netzwerk für Gesundheit | Berlin |
| Prof.Dr. Gunter Haroske | Dresden | |
HL7 Deutschland e.V.
Geschäftsstelle Köln
An der Schanz 1
50735 Köln
Implementierungsleitfaden
Pathologie-Befunde auf Basisvon HL7 CDA Rel.2
zur Abstimmung durch die Mitglieder von HL7 Deutschland e.V.
Ansprechpartner:
Dr. Frank Oemig, Agfa HealthCare GmbH (Bonn)
Dokumentinformation
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Impressum
For the Anatomic Pathology Structured Report Version 2.0 (APSR 2.0), an IHE Project, the existing German "Leitfaden Pathologiebefund" has been modified to an IHE Technical Framework document, starting from the IHE reference text APSR, Trial Implementation, to be linked with Art-Decor for the specification of value sets, terminologies, and templates according HL7/CDA.
Dieser Leitfaden wird von einer Arbeitsgruppe des Interoperabilitätsforum in Kooperation mit dem Berufsverband der Pathologen erstellt. Er basiert auf dem Leitfaden "Arztbrief 2014", der parallel hierzu durch eine Arbeitsgruppe des Interoperabilitätsforums erstellt wird.
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Contact
- IHE PaLM, palm@ihe.net
- Prof.Dr. Gunter Haroske, BVDP, Berlin, haroske@icloud.com
- Francois Macary, PHAST, Paris, francois.macary@phast.fr
- Dr. Frank Oemig, Deutsche Telekom Healthcare Solutions GmbH, Bonn, Frank.Oemig@t-systems.de
- Dr. Kai-Uwe Heitmann, hl7@kheitmann.de
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Authors and copyrights, terms of use
Copyright permissions
This document has been developed by Agfa HealthCare GbmH, Bonn, in cooperation with the HL7 user group Germany e.V. The claims for use or publication are not restricted.
The content of this specification is public.
It should be noted that parts of this document are based on the reconciliation package 2 of May 17, 2009 and the HL7 version 3 normative edition 2008, for which © Health Level Seven, Inc. applies. For further information see http://www.hl7.de/ and http://www.hl7.org/.
The extension or rejection of the specification, in whole or in part, shall be notified in writing to the board of the user group and to the editors / authors.
All HL7 specifications, adapted and published to national circumstances, can be used in any type of application software without license and usage fees.
Health Level Seven, Inc. has granted permission to the IHE to reproduce tables from the HL7 standard. The HL7 tables in this document are copyrighted by Health Level Seven, Inc. All rights reserved. Material drawn from these documents is credited where used.
Disclaimer
Although this publication has been compiled with the utmost care, neither HL7 Deutschland e.V. nor the companies involved in the creation can assume any liability for direct or indirect damage that could arise through the content of this specification.
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Foreword
This is a supplement to the IHE Pathology and Laboratory Medicine Technical Framework V8.0. Each supplement undergoes a process of public comment and trial implementation before being incorporated into the volumes of the Technical Frameworks.
This supplement was published on September 27, 2017 for Public Comment, with a comment period extending to mid-November. The current content is the Trial Implementation version, which has taken in consideration the comments received.
This supplement describes changes to the existing technical framework documents.
“Boxed” instructions like the sample below indicate to the Volume Editor how to integrate the relevant section(s) into the relevant Technical Framework volume.
Replace Section X.X by the following:
Where the amendment adds text, make the added text bold underline. Where the amendment removes text, make the removed text bold strikethrough. When entire new sections are added, introduce with editor’s instructions to “add new text” or similar, which for readability are not bolded or underlined.
General information about IHE can be found at: http://www.ihe.net.
Information about the IHE Pathology and Laboratory Medicine domain can be found at: http://ihe.net/IHE_Domains.
Information about the structure of IHE Technical Frameworks and Supplements can be found at: http://ihe.net/IHE_Process and http://ihe.net/Profiles.
The current version of the IHE Technical Framework (if applicable) can be found at: http://ihe.net/Technical_Frameworks.
Comments may be submitted on IHE Technical Framework templates any time at http://ihe.net/ihetemplates.cfm. Please enter comments/issues as soon as they are found. Do not wait until a future review cycle is announced.
Acknowledgements
Following authors mainly contributed to this document:
- Francois Macary, PHAST, Paris
- Dr. Gunter Haroske, Federal Association of German Pathologists, Berlin
- Dr. Frank Oemig, Deutsche Telekom Healthcare Solutions GmbH, Bonn
- Dr. Riki Merrick, APHL, San Francisco
- Dr. Raj Dash, Duke University, Durham
They have to acknowledge the contributions of Dr. Kai U. Heitmann, who managed the cooperation between PaLM and ART-DECOR. It was the very first time that a complete IHE TF document could be developed by means of the ART-DECOR tools and a media wiki.
Inhaltsverzeichnis
- 1 Impressum
- 2 Contact
- 3 Authors and copyrights, terms of use
- 4 Foreword
- 5 Acknowledgements
- 6 Introduction to this Supplement
- 7 Dynamisches Modell / Dynamic Model
- 8 Statisches Modell / Static Model
- 8.1 Übersicht / Survey
- 8.2 Gesamtstruktur
- 8.3 Dokumenttypen / Document types
- 8.3.1 Use Cases
- 8.3.2 Dokumentenstruktur des Pathologiebefundberichts / Structure of the Anatomic Pathology Report
- 8.3.2.1 Sections, Entries und Child Elements
- 8.3.2.2 Allgemeine Beschränkungen des Pathologiebefundes (IHE APSR) gegenüber einem CDA R2 Dokument / General constraints added by IHE PAT to a CDA R2 document
- 8.3.2.3 Spezielle Beschränkungen des Pathologiebefundes gegenüber IHE-APSR (National Extensions) / Special constraints added by the Anatomic Pathology Report to IHE-APSR (National Extensions)
- 8.3.2.4 Allgemeine Struktur des Pathologiebefundes CDA R2
- 8.3.3 Abschnitte des Befundberichtes / Sections of the APSR
- 9 CDA-Header
- 10 CDA Body
- 11 Anhang A: Diverses
Introduction to this Supplement
This supplement complements volume 1 of the PaLM technical framework with the description of the APSR 2.0 content profile, and volume 3 with the bindings, content modules and value sets, which specify this profile.
Open Issues and Questions
None yet
Closed Issues
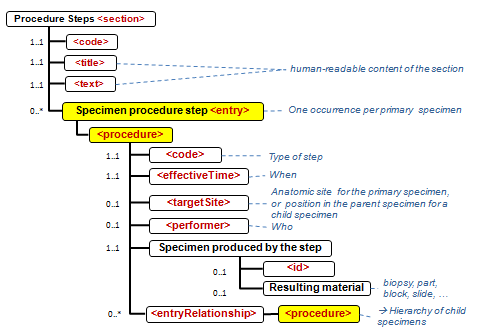
APSR-07 – Representing the hierarchy of specimens in an entry : This APSR supplement enables to represent the hierarchy of specimens at the CDA level 3. The operations on specimen and production of child specimens are tracked in the “Procedure Steps” section, which has a level 3 entry.
APSR-10 – Observation related to multiple specimens: For example tumor staging may require combining data from multiple specimens (e.g., a breast excision with positive margins followed by a re-excision with clear margins – in this case the tumor size may be a composite of measurements from both specimens. Another example is staging of ovarian carcinomas with multiple biopsies of pelvis, peritoneum, nodes, omentum, etc.). To accommodate these use cases, each problem organizer as well as each observation may reference any number of specimens using the <specimen> child element. Each of these references may point to a detailed description of the specimen, in the "procedure steps" section.
APSR-11 – Derivative specimens:Specimens derived from primary specimens for ancillary studies, which may be sent to a reference lab or done in another part of the same institution, are included in the scope of this profile. The results produced on a derived specimen are attached to this specimen in the report.
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Dynamisches Modell / Dynamic Model
Übersicht / Survey
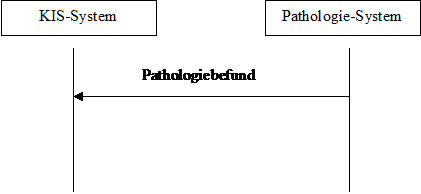
Das dynamische Modell sieht das relativ einfach aus:
The dynamic model looks rather simple:
Abbildung 1: dynamisches Modell Figure 1: dynamic model
Im Prinzip agiert das Pathologiesystem als Content Creator und das KIS-System als Content Consumer. Entsprechend können auch andere Systeme diese beiden Rollen übernehmen.
The Pathology Management System (PMS sive LIS) acts as Content Creator, whereas the Hospital Information System (HIS) plays the role of the Content Consumer. Other systems may play those roles, too.
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Statisches Modell / Static Model
Übersicht / Survey
In diesem Abschnitt wird grob der Aufbau und die Struktur von HL7 CDA R2 Dokumenten erläutert (entnommen aus dem Implementierungsleitfaden des VHitG-Arztbriefes, Kapitel 3).
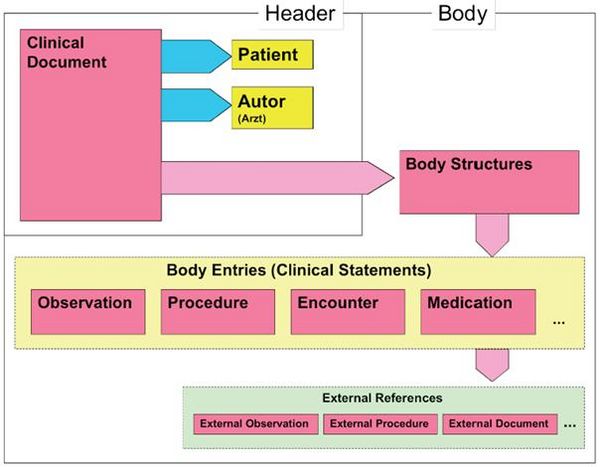
Wie alle Spezifikationen von Nachrichten in HL7 basiert auch die Clinical Document Architecture auf dem RIM und ist als HL7 V3 Modell repräsentiert. Grob gesprochen besteht ein CDA Dokument aus einem Header und einem Body, der wiederum Body Structures und Body Entries aufweist. An die Entries können externe Referenzen (External References) geknüpft sein. Der folgende Überblick zeigt die Hauptkomponenten des CDA R2 Modells auf und in der folgenden Abbildung ist das Ganze in XML-artiger Darstellung gezeigt.
As all HL7 specifications of messages the Clinical Document Architecture (CDA) is based on the Reference Information Model (RIM) and represented as HL7 V3 model. Roughly a CDA document consists of a header and a body, which contains Body Structures and Body Entries. The latter may be linked with external references. The figures 2 and 3 below show the main components of the CDA R2 model also in a xml-like fashion.
Abbildung 2: CDA-RMIM (vereinfachte Darstellung)
Die nachfolgende vereinfachte Graphik zeigt die Darstellung in XML:
Abbildung 3: CDA Level 3 Entries (vereinfachter Ausschnitt)
Die Informationen zum Patienten, zum Dokument selbst, zu den weiteren beteiligten Personen und Organisationen sowie der dokumentierten Episode (Zeitereignisse) sind zum CDA Header zusammengefasst, hochstrukturiert und von der Semantik her festgelegt.
Die Informationen im Header unterstützen einen Austausch klinischer Dokumente über Institutionsgrenzen hinweg. Er trägt Informationen über das Dokument selbst (eine eineindeutige Identifikation, eine Andeutung des Typs des Dokuments), über „Teilnehmer" am Dokument (an der Dokumentation beteiligte Heilberufler, Autoren, und natürlich den Patienten selbst), sowie über Beziehungen zu Dokumenten (zu Anforderungen und anderen Dokumenten). Mit den Informationen des Headers werden Dokumentenmanagementsysteme unterstützt, der Header stellt dafür entsprechende Mechanismen zur Verfügung. Schließlich hat man mit den im CDA Header verfügbaren Informationen die Zusammenführung einer individuellen (lebenslangen) Patientenakte vor Augen.
Information to the patient, to the document itself, to further persons and organizations who participate, as well as to the time period of documentation are comprised in the CDA Header, highly structured and defined by their semantics.
The header information supports the exchange of clinical documents across institution barriers. The header carries information about the document itself (unequivocal identification, type of document), about participants in the document (participating health officials, authors, and of course, the patient), as well as about relations to documents (queries and other documents). With the header information document management systems are supported. Finally, with the header information the compilation of a (livelong) health record of a patient is aimed.
Gesamtstruktur
|
|
Anm.: Die folgende Abbildung muss noch an die im weiteren ausgeführten Gliederungen angepasst werden. |
Abbildung 4: Gesamtstruktur
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Dokumenttypen / Document types
Pathologiebefunde erfassen alle Bereiche der Klinischen Pathologie (synonym "surgical pathology"), d.h. gut- und bösartige Tumoren, nichtneoplastische Läsionen, zytopathologische Befunde und Autopsien / Obduktionen. Zweit-/Nachberichte, Konsiliarberichte und Zytologische Befunde (gynäkologisch und nicht-gynäkologisch) weisen die gleiche Grundstruktur auf und sollten daher keine separaten Dokumententypen sein.
In IHE Anatomic Pathology Technical Framework Supplement Anatomic Pathology Structured Reports (APSR) Trial Implementation Tab. 5.6-1 wird durchgängig 11526-1 als Dokumententyp verwendet.
Obduktionsgutachten sind zwar anders aufgebaut als die Befundberichte zu Biopsien, Resektaten oder zytologischen Präparaten, stimmen aber in ihren Grundelementen überein. Sie sollten daher lediglich als ein spezielles Template behandelt werden. Von IHE wurden Autopsie-/Obduktionsbefunde bisher nicht erörtert.
In IHE-XDS-Registern können eine Klasse und feiner granulierte Typen angegeben werden. In CDA gibt es nur einen „Code“. Wir interpretieren das als den Typ, beim Registrieren kann dann die grobe Klassifizierung einfach ermittelt werden (umgekehrt wäre es schwierig). Einigen wir uns also auf 11526-1 "Pathology study" als Dokumentenklasse, darunter die beiden Dokumententypen 11529-5 und 18743-5.
Anatomic Pathology Reports about benign and malignant tumors and non-neoplastic lesions as well comprise all fields of Clinical Pathology (sive Surgical Pathology). Second opinion reports, additional reports, and cytopathologic reports have the same basic structure and should therefore not handled as separate document types.
In IHE Anatomic Pathology Technical Framework Supplement Anatomic Pathology Structured Reports (APSR) Trial Implementation Tab. 5.6-1 "11526-1" is generally used as document type.
Although Autopsy reports have the same basic elements as Pathology reports, they often show a different basic structure. They should be handled by specialized templates. Autopsy reports are not yet in the scope of IHE-Anatomic Pathology.
In IHE-XDS-Registries a class and more granulated types can be used. In CDA only a code is used. 11526-1 "Pathology study" should be understood as document class, beneath the both types 11529-5 und 18743-5 could be used for a finer granulation.
| Code | Dokumenttyp | Taxonomielevel |
|---|---|---|
| 11526-1 | Pathologisch- anatomische Begutachtung / Pathology study | 3 |
| 11529-5 | Pathologisch- anatomische Begutachtung / Surgical pathology study | 4 |
| 18743-5 | Obduktions-/ Sektionsgutachten / Autopsy report | 4 |
In der Taxonomie der Dokumenttypen finden sich die Spezifikationen für die beiden Dokumententypen im Taxonomielevel 4.
In the taxonomy of document types those specifications are to be found in taxonomy level 4.
Use Cases
Regelfall
Barbara Brust wird durch Dr. Christian Chirurg zur Entfernung eines Brusttumors aufgenommen. Dr. Christian Chirurg ordert die Untersuchung “Mammaexzisat - Pathohistologische Untersuchung” und sendet die Probe(n) zum Institut für Pathologie.
Die Probe(n) triftt im Institut ein. Dr. Peter Pathologe führt die makroskopische Untersuchung und den Zuschnitt durch; wenn nötig, werden Makrobilder aufgenommen. Die Probe(n) werden im Labor für die histologische Untersuchung einschließlich Spezialuntersuchungen aufbereitet, eine Gewebsasservation findet, falls nötig, statt. Während der mikroskopischen Untersuchung werden, falls nötig, Mikrobilder aufgenommen. Nach der mikroskopischen Untersuchung ruft Dr. Peter Pathologe die Content Creator Anwendung für das entsprechende APSR Template auf, füllt es aus, bindet relevante Bilder mit ROI ein und schließt den Fall ab. Nach Diktat und Kontrolle wird der Befund durch die Oberärztin Dr. Pauline Pathologin freigegeben.
Probengewinner ist nicht der Einsender
In Deutschland nicht üblich, Ablauf ansonsten wie Regelfall.
Mehrstufiger Bericht(Zweit-/Nachbericht)
Für Zweit-, besser Nachberichte gilt, dass sie neue Informationen zu einem bereits vorhandenen Befund hinzufügen (nachträgliche Spezialuntersuchungen, Zweitmeinungen, Konsiliarbefunde, Antworten auf klinische Fragestellungen, etc.). Damit besitzen sie die gleiche Struktur. Sie beziehen sich dabei immer auf einen vorhandenen Befund, in dem sie u.U. auch schon angekündigt werden (siehe ELGA-Beispiel). Sie stellen aber ein eigenes Dokument dar. Insofern muss geklärt werden, wie Beziehungen zwischen diesen Dokumenten hergestellt werden. (RPLC ist nicht geeignet, da das für die Versionierung genutzt werden muss. APND stellt schon eher das adäquate Konstrukt dazu dar.) Diese Art der Befunde müssen dann aber nicht separat modelliert werden.
Barbara Brust wird durch Dr. Christian Chirurg zur Entfernung eines Brusttumors aufgenommen. Dr. Christian Chirurg ordert die Untersuchung “Mammaexzisat - Schnellschnitt und Pathohistologische Untersuchung” und sendet die Probe(n) zum Institut für Pathologie.
Die Probe(n) triftt im Institut ein. Dr. Paul Putzig führt die makroskopische Untersuchung und den Zuschnitt durch; wenn nötig, werden Makrobilder aufgenommen. Die Probe(n) für den intraoperativen Schnellschnitt werden im Labor bearbeitet, Frischgewebe für eine Tumorbank wird entnommen. Während der mikroskopischen Untersuchung des Gefrierschnitts fordert Dr. Paul Putzig den Content Creator für das entsprechende APSR Template an, füllt die Felder aus, bindet relevante Bilder und /oder ROIs ein und signiert den vorläufigen Befund. Am nächsten Tag werden die Probe(n)für die histologische Untersuchung einschließlich Spezialuntersuchungen aufbereitet. Während der mikroskopischen Untersuchung werden, falls nötig, Mikrobilder aufgenommen. Nach der mikroskopischen Untersuchung ruft Dr. Peter Pathologe die Content Creator Anwendung für das entsprechende vorläufige APSR Template auf, füllt es aus, bindet relevante Bilder mit ROI ein und schließt den Fall endgültig ab. Nach Diktat und Kontrolle wird der Befund durch die Oberärztin Dr. Pauline Pathologin freigegeben.
Konsiliarbefund
Ein Konsiliarbefund stellt einen eigenständigen Befundbericht mit allen dafür notwendigen Abschnitten dar, der vom konsilsuchenden Auftraggeber (Pathologen) in dessen Erstbefund aufgenommen oder als Nachbericht an einen Erstbefund angefügt wird.
Es gibt verschiedene Situationen, in denen ein Konsiliarbefund angefordert wird:
- Externe Expertenkonsultation(erbeten durch Phillip Pathologe, oft bevor ein engültiger Befund fertiggestellt wird). - Bitte um eine Zweite Meinung(üblicherweise durch den behandelnden Arzt, den Patienten, seiner Familie oder in juristischem Zusammenhang). - Externe Schnittbegutachtung (üblicherweise Routinebegutachtung von Schnitten, die durch Protokolle einer externen Behandlungseinrichtung notwendig wird). Dies kann im Workflow und auch im zu begutachtenden Material variieren.
Anfordernder Pathologe
Phillip Pathologe bittet um eine zweite Meinung im Fall von Peter Patient, bei dem er ein malignes Lymphom diagnostizierte. Er sendet Blöcke oder Schnitte oder WSI zu Dr. Patrizia Pathologin und bittet sie um ihre (Experten-)Meinung zu diesem Material. Er verwendet die Content Creator Anwendung zur Erzeugung einer Konsultationsanfrage zum vorläufigen Befund von Peter Patient. Phillip Pathologe verwendet später seine Content Consumer Anwendung um den Befund von Dr. Patrizia Pathologin zu lesen und in seinen Befundbericht zu integrieren. Er verwendet diesen Befund daher um seinen eigenen Befund abzuschließen und mit seiner Anwendung als Content Creator zu agieren. Dabei wird ein vorläufiger Befundbericht fertiggestellt oder ein Zweit/Nachbericht zum Erstbericht erstellt.
Angefragter Pathologe
Dr. Patrizia Pathologin willigt ein, eine zweite Meinung zum Fall des Peter Patient abzugeben.
Blöcke
Die Proben werden für die mikroskopische untersuchung und notwendige zusätzliche Untersuchungsverfahren bearbeitet. Während des Mikroskopierens werden, falls nötig, Bilder aufgenommen. Zum Abschluss ihrer Untersuchungen ruft Dr. Patrizia Pathologin den Content Creator für das entsprechende APSR Template auf, füllt es aus, bindet Bilder und ROIs ein, und gibt den Befundbericht frei.
Schnitte
Während des Mikroskopierens werden, falls nötig, Bilder aufgenommen. Zum Abschluss ihrer Untersuchungen ruft Dr. Patrizia Pathologin den Content Creator für das entsprechende APSR Template auf, füllt es aus, bindet Bilder und ROIs ein, und gibt den Befundbericht frei.
WSI (Virtual slides)
Zum Abschluss ihrer Untersuchungen ruft Dr. Patrizia Pathologin den Content Creator für das entsprechende APSR Template auf, füllt es aus, bindet Bilder und ROIs ein, und gibt den Befundbericht frei.
Dokumentenstruktur des Pathologiebefundberichts / Structure of the Anatomic Pathology Report
Sections, Entries und Child Elements
IHE verwendet den Begriff der Content Module für unterschiedliche Hierarchie-Ebenen:
Auf der höchsten Ebene der Document Content Module (Dokumententypklasse LOINC 11526-1) ist der generische Anatomic Pathology Structured Report (1.3.6.1.4.1.19376.1.8.1.1.1) als Template für das gesamte Dokument, den Pathologiebefund, vorgesehen. Bisher ca. 20 Organ Specific APSR (1.3.6.1.4.1.19376.1.8.1.1.2.1 bis -2.20) werden als Templates für organspezifische Tumor-APSR in einer Appendix des APSR-Supplements für optionale Verwendung vorgehalten.
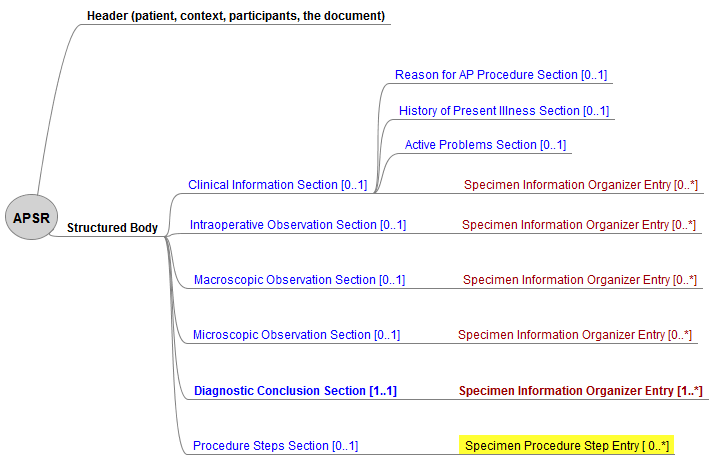
Nach IHE sind 6 Sections als Templates für <section> Elemente vorgesehen.
Diese können teilweise durch Entries als Templates für <entry> Elemete ergänzt werden (vgl. Fig. 4.1.2.1-1 APSR).
Child Elemente sind Templates für Elemente des CDA Headers oder für <section> Elemente oder für Elemente, die in verschiedenen Tiefen unterhalb eines <entry> Elements verschachtelt werden oder für ein Element aus Kombinationen dieser genannten.
Die OID Hierarchie der IHE ist wie folgt:
- 1.3.6.1.4.1.19376.1.8 Pathologiedomäne
- 1.3.6.1.4.1.19376.1.8.1 CDA Content Module
- 1.3.6.1.4.1.19376.1.8.1.1 Document Content Module
- 1.3.6.1.4.1.19376.1.8.1.2 Section Content Module
- 1.3.6.1.4.1.19376.1.8.1.3 Entry Content Module
- 1.3.6.1.4.1.19376.1.8.1.4 Element Content Module
- 1.3.6.1.4.1.19376.1.8.2 Terminologien
- 1.3.6.1.4.1.19376.1.8.2.1 PathLex
- 1.3.6.1.4.1.19376.1.8.5 Value Sets
- 1.3.6.1.4.1.19376.1.8.9 Beispielinstanzen
- 1.3.6.1.4.1.19376.1.8.1 CDA Content Module
Die Grundstruktur eines Befundes im deutschsprachigen Raum ist: Material - Makroskopische Beurteilung - Mikroskopische Beurteilung - Diagnose - Zusammenfassung. Diese wird durch o.g. Struktur vollständig abgebildet.
Der Pathologiebefundbericht als Sonderfall des Arztbriefs kann also weitgehend durch Verwendung von Arztbrief- und IHE-Templates als CDA R2-Dokument gestaltet werden.
At the highest level of Document Content Modules (document type class LOINC 11526-1) the generic Anatomic Pathology Structured Report (1.3.6.1.4.1.19376.1.8.1.1.1) is the template for the entire Pathology report. Up to now 20 Organ Specific APSR (1.3.6.1.4.1.19376.1.8.1.1.2.1 through -2.20) have been reserved as templates for organ-specific tumor-APSR in an appendix of the IHE-APSR Supplement.
This document content modul contains up to 6 Sections as templates for <section> elements.
Those can be added by Entries as templates for <entry> elements (see Fig. 4.1.2.1-1 APSR).
Child Elemente are templates for elements of the CDA header or for <section> elements or for elements, which are nested at various depths below an <entry>, or an element appearing at some combination of these locations.
The OID hierarchy of IHE is as follows:
- 1.3.6.1.4.1.19376.1.8 Pathology domain
- 1.3.6.1.4.1.19376.1.8.1 CDA Content Module
- 1.3.6.1.4.1.19376.1.8.1.1 Document Content Module
- 1.3.6.1.4.1.19376.1.8.1.2 Section Content Module
- 1.3.6.1.4.1.19376.1.8.1.3 Entry Content Module
- 1.3.6.1.4.1.19376.1.8.1.4 Element Content Module
- 1.3.6.1.4.1.19376.1.8.2 Terminologies
- 1.3.6.1.4.1.19376.1.8.2.1 PathLex
- 1.3.6.1.4.1.19376.1.8.5 Value Sets
- 1.3.6.1.4.1.19376.1.8.9 Instances in the examples built by the PAT TF
- 1.3.6.1.4.1.19376.1.8.1 CDA Content Module
The basic structure of an Anatomic Pathology Report in German speaking countries is: Specimen - Macroscopic evaluation - Microscopic evaluation - Diagnosis - Summary. This is completely mirrored by the structure described above.
The Pathology Report as a special (constrained) case of a discharge letter can also be derived from the German HL7 Discharge letter and from IHE-APSR templates as a valid CDA R2 document.
Any AP structured report SHALL be associated with the following metadata:
- typeCode = 11526-1, which is the LOINC code for “Pathology study”.
- formatCode = urn:ihe:pat:apsr:all:2010, with associated codingScheme = 1.3.6.1.4.1.19376.1.2.3 as assigned by the ITI Domain for codes used for the purposes of cross-enterprise document sharing (XDS).
- The media type SHALL be “text/xml”.
Allgemeine Beschränkungen des Pathologiebefundes (IHE APSR) gegenüber einem CDA R2 Dokument / General constraints added by IHE PAT to a CDA R2 document
Im strukturierten Body hat eine Section einen narrativen Block (text Element), der den lesbaren Inhalt der Section repräsentiert und der ein oder mehrere Entries haben KANN. Sections KÖNNEN ineinander verschachtelt sein,
Folgende Einschränkungen gelten:
- Wenn eine Section ein text Element und entry Elemente hat, dann MUSS der maschinenlesbare Inhalt vollständig in lesbaren Inhalt ins text Element transskribiert werden.
- Das text Element KANN Informationen enthalten, die nicht im maschinenlesbaren entry Element enthalten sind.
- Die entry Elemente werden nach Specimen oder Gruppen von Specimen instantiiert. Unterhalb eines entry Elements erfolgt die Organisation der Observations nach dem Problem.
- Das text Element einer Section sollte im Layout ebenfalls nach Specimen oder Gruppe von Specimen gegliedert werden.
- Das Layout des text Elementes obliegt der Content Creator Applikation oder weiteren Einschränkungen durch Nationale Körperschaften. Die Content Creator Applikation MUSS Freitext und aus entry Elementen transskribierten Text separat behandeln und sicherstellen, dass ein Überschreiben von Freitext durch transskribierten Text verhindert wird.
- Zu übertragende Information MÜSSEN Unterscheidungen klar identifizieren hinsichtlich:
- None: Es ist sicher bekannt, dass es keine Information gibt.
- None known: Es ist derzeitig nicht sicher bekannt, ob es keine Information gibt.
- Asked but unknown:Die Information wurde nachgefragt, konnte aber nicht erhalten werden (Ergebnis einer Untersuchung nicht bekannt).
- Unknown: Die Information ist unbekannt oder anderweitig nicht verfügbar.
- Other, not specified: Der Wert gehört nicht zum vereinbarten Wertesatz und wird vom Autor überhaupt nicht mitgeteilt.
- Other, specify: Der Wert gehört nicht zum vereinbarten Wertesatz und wird vom Autor als fremder Wert mitgeteilt.
- Not applicable: Es gibt keinen anwendbaren Wert für den gegebenen Kontext.
Sections, die R oder R2 Status haben und über keine Informationen verfügen, sollten eine dieser Begriffe im text Element verwenden.
Strukturelemente mit R oder R2 Status, die über keine Information verfügen solten ein "nullFlavor" Attribut zur Codierung des Grundes der fehlenden Information verwenden.
| Situation | nullFlavor | HL7 Definition |
|---|---|---|
| Asked but unknown | ASKU | Information wurde gesucht aber nicht gefunden |
| Unknown | UNK | Ein Wert wäre anwendbar, aber nicht vorhanden |
| Other, not specified | OTH | Der Wert ist kein Element aus der betreffenden Wertedomäne |
| Not applicable | NA | Es gibt keinen geeigneten Wert in diesem Kontext |
| Temporarily not available | NAV | Information ist im Moment nicht verfügbar, wird aber erwartet |
Die Situationen "None" und "None known" sind effektive Werte in den zugehärigen Wertesätzen. Die Situation "Other, specify" kann auf zweierlei Art gehandhabt werden:
- das code Attribute wird leer gelassen und die Antwort wird im nichtkodierten originalText Attribut aufgeführt,
- ein kodierter Wert aus einem anderen Codeschema wird eingetragen, wenn die Kodierungsstärke dieses Elements mit "CWE" (coded with extensions)definiert ist. Die Attribute code, display name und codeSystemName beschreiben dann den fremden Code.
Für zusätzliche Untersuchungstechniken wird die Situation "nicht durchgeführt" oder "nichts durchgeführt" durch den nullFlavor=NAV repräsentiert.
In the structured body of a CDA R2 document, a section has a narrative block (the text element), which presents the human-readable content of the section, and MAY have one entry or more. Sections MAY be nested within one another.
The content modules designed by the PAT TF bring or highlight the following constraints:
- When a section has a text element and one or more entry element, the content coded for machine-processing in the entries SHALL be completely transcribed into human-readable content in the textelement.
- Conversely the text element MAY contain pieces of information, which are not available in machine-readable format in any entry element of the section.
- For a document of the Anatomic Pathology domain, the entry elements are instantiated per specimen or per group of specimens observed together. One entry contains in machine-readable format observations of the section related to the same specimen or group of specimens. Beneath an entry, the observations are organized per problem.
- The text element of the section is supposed to be also laid out per specimen or group of specimens and per problem observed.
- The APSR Content Profile leaves the layout of the text element up to the Content Creator applications, or to further constraints brought by national extensions of this profile. However, given that the text element is usually composed of free text (e.g. dictated text), assembled with the text generated from the set of data, machine-encoded in the entry elements below, the Content Creator application MUST handle these two kinds of content, and provide a user interface, which avoids risks of overwriting text automatically derived from the entries with free text typed in by the user (e.g., using forms with dedicated free text areas and distinct protected areas for text generated out of structured data).
- Information that is sent SHALL clearly identify distinctions between:
- None: It is known with complete confidence that there are none. This indicates that the sender knows that there is no relevant information of this kind that can be sent.
- None Known: None known at this time, but it is not known with complete confidence that none exist.
- Asked but unknown: The information was requested but could not be obtained. Used mainly in the context where an observation was made but the result could not be determined.
- Unknown: The information is not known, or is otherwise unavailable.
- Other, not specified: The actual value does not belong to the assigned value set and is not reported at all by the author.
- Other, specify: The actual value does not belong to the assigned value set and the author of the report provides this foreign value anyway.
- Not applicable: No proper value is applicable in this context.
Sections that are required to be present but have no information should use one of the above phrases where appropriate in the text element.
Structural elements that are required but have no information shall provide a "nullFlavor" attribute coding the reason why the information is missing.
| Situation | nullFlavor | HL7 Definition |
|---|---|---|
| Asked but unknown | ASKU | information was sought but not found |
| Unknown | UNK | A proper value is applicable, but not known. |
| Other, not specified | OTH | The actual value is not an element in the value domain of a variable. (e.g., concept not provided by required code system). |
| Not applicable | NA | No proper value is applicable in this context |
| Temporarily not available | NAV | Information is not available at this time but it is expected that it will be available later. |
The two situations “None” and “None known” represent effective values, which are part of the related value sets.The situation “Other, specify” can be handled in two ways in a coded data element:
- Leaving empty the code attribute and providing the non-coded answer in the originalText attribute.
- Providing a value coded from a different coding scheme, when the coding strength of the element is "CWE"(coded with extensions). The attributes code, displayName, codeSystem and codeSystemName then describe the foreign code.
- For ancillary techniques, the situation "not performed" or "none performed" is represented by nullFlavor = NAV.
Spezielle Beschränkungen des Pathologiebefundes gegenüber IHE-APSR (National Extensions) / Special constraints added by the Anatomic Pathology Report to IHE-APSR (National Extensions)
 |
Gibt es derartige weitere Beschränkungen (z.B. Umgang mit Tumorformeln, Value sets bzgl. Organspezifität etc.)?? GH |
Organspezifische Document Content Module mit organspezifischen Beschränkungen in den Specimen Collection Procedures und AP Observations sind nicht vorgesehen.
Im Gegensatz zu IHE_APSR sind die Sections Intraoperative Untersuchung, Makroskopische Beurteilung, Mikroskopische Beurteilung sowie ausführliche gutachterliche Stellungnahme obligatorisch.
Organ specific Document Content Modules with organ specific constraints in Specimen collection procedures and AP Observations are not defined.
In contrast to IHE APSR the sections "Intraoperative Observation", "Macroscopic Observation", and "Microscopic Observation" are mandatory.
Allgemeine Struktur des Pathologiebefundes CDA R2
Die allgemeine Struktur eines Pathologieberichtes hinsichtlich seiner maschinenlesbaren Inhalte gestaltet sich wie von IHE-APSR vorgeschlagen:
 |
Die Abbildung weist eine Abweichung von der XML-Struktur im Beispiel auf: der component-Tag wird hier nicht dargestellt. --Tschrader 23:14, 31. Jul. 2013 (CEST) |
- in den Sections 1 - 5 werden werden keine Specimen collection procedure-Entries genutzt: Jede Observation oder Batterien von Observations werden durch eine Referenz auf das Specimen und das Problem, zu dem sie gehören, gebunden.
- die Informationen zu den Specimen (Proben, Materialien) werden in der (Procedure steps) Materialaufbereitungs Section durch das Specimen procedure step entry zentralisiert, so dass jedes Specimen jeder Hierarchstufe identifiziert werden kann (s.auch cdapath:Materialaufbereitung-Section (Template)).
Abschnitte des Befundberichtes / Sections of the APSR
Die Abschnitte des Befundberichts, untergliedert nach Sections und Entries, sind in nachfolgender Tabelle aufgelistet.
| Lvl | Dokumentabschnitt | Hierarchie | Pathologisch- anatomische Begutachtung/ Erstbericht |
Obduktions-/ Sektions- gutachten |
LOINC | Sektorkommitee | (IHE) OID |
|---|---|---|---|---|---|---|---|
| 1 | Anrede | Section | 0..1 | 0..1 | nein | ||
| 1 | Vorbefunde | Section | 0..1 | 0..1 | nein | ||
| 1 | Klinische Information | Section | 0..1 | 0..1 | 22636-5 | nein | 1.3.6.1.4.1.19376.1.8.1.2.1 |
| 2 | - Fragestellung | SubSection | 0..1 | 0..1 | 42349-1 | nein | 1.3.6.1.4.1.19376.1.5.3.1.3.1 |
| 2 | - Anamnese | SubSection | 0..1 | 0..1 | 10164-2 | nein | 1.3.6.1.4.1.19376.1.5.3.1.3.4 |
| 2 | - "Active problem" | SubSection | 0..1 | 0..1 | 11450-4 | nein | 1.3.6.1.4.1.19376.1.5.3.1.3.6 |
| 1 | Intraoperative Untersuchung | Section | 0..* | tbd | ja | 1.3.6.1.4.1.19376.1.8.1.2.2 | |
| 1 | Makroskopische Beschreibung | Section | 1..* | 22634-0 | ja | 1.3.6.1.4.1.19376.1.8.1.2.3 | |
| 1 | Mikroskopische Beschreibung | Section | 1..* | 1..1 | 22635-7 | ja | 1.3.6.1.4.1.19376.1.8.1.2.4 |
| 1 | Diagnose | Section | 1..* | 22637-3 | ja | 1.3.6.1.4.1.19376.1.8.1.2.5 | |
| 2 | - ausführliche kritische gutachterliche Stellungnahme/Epikrise/Kommentar | SubSection | 0..1 | 0..1 | 35660-0 | ja | 1.3.6.1.4.1.19376.1.8.1.2.7 |
| 1 | Materialaufbereitung | Section | 1..* | 1..1 | 46059-2 | ja | 1.3.6.1.4.1.19376.1.8.1.2.6 |
| 1 | Äußere Leichenschau | Section | 1..1 | ||||
| 1 | Innere Leichenschau | Section | 1..1 | ||||
| 1 | Unterbeauftragung | Section | 0..* | 0..* | ja | ||
| 1 | Diagnose(n) konsiliarischer Untersuchungen | Section | 0..* | 0..* | ja | ||
| 1 | Schlusstext | Section | 0..1 | 0..1 | nein |
Tabelle 1: Abschnitte des Befundberichts, deren Inhalt und zugehörige LOINC-Codes
(Level gibt hier die Schachtelung der Spezifikation an, d.h. ein höher Level bedeutet die Inklusion in einer vorhergehenden Section. Das ist kein Aussage über den CDA-Level, der den Grad der Kodierung angibt.)
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
CDA-Header
Die Regelungen zum Header können aus dem VHitG-Arztbrief, Kapitel 7, vollständig übernommen werden. Einzig die Liste der teilnehmenden Personen (participants) ist um den Einsender zu ergänzen, der in der Regel auch der beabsichtigte Empfänger des Dokuments (informationRecipient) ist. Er ist nicht identisch mit einem Ein- oder Überweiser.
IHE_APSR_TF_Supplement-2011-03-31 schlägt dafür noch zwei weitere participant-Rollen vor:
- Ordering physician (participant[@typeCode="REF"]/templateId[@root="1.3.6.1.4.1.19376.1.3.3.1.6"], HL-7 ORC-12, OBR-16, ORC-9
- Specimen collector (participant[@typeCode="DIST"]/templateId[@root="1.3.6.1.4.1.19376.1.8.1.4.1"], HL-7 OBR-10, SPM-17.
Beide in der usage-Kategorie R2 (required, if known)
Weiterhin gibt es den Dokumentenstatus, der durch das Code Element lab:statusCode unter documentationOf/serviceEvent als Extension zum CDA R2 Standard repräsentiert wird, um einen "vorläufigen Befund (lab:statusCode@code="active") von einem endgültigen Befund (lab:statusCode@code="completed") zu unterscheiden. Diese Extension wird geschützt durch einen Namespace assoziiert mit dem ClinicalDocument Element zum Präfix lab: <Clinical Document xmlns:lab="urn:oid:1.3.6.1.4.1.19376.1.3.2" … >
 |
GH: Ist das schon berücksichtigt? |
Die weiteren Ausführungen erübrigen sich damit bis auf die Dokumententypisierung!
In diesem Abschnitt werden die Elemente des CDA Headers erläutert, die zwingend in den CDA HL7 R2 Arztbrief einzubinden sind.
Alle XML Arztbriefe beginnen mit dem Wurzelelement ClinicalDocument und der vorgeschriebene Zeichensatz ist UTF-8.
Daraus ergibt sich folgende Struktur, die wie aufgeführt umzusetzen ist. Dabei sind fett gedruckte Bereiche unverändert einzubauen.
<?xml version="1.0" encoding="UTF-8"?>
<ClinicalDocument
xmlns="urn:hl7-org:v3"
xmlns:voc="urn:hl7-org:v3/voc"
xmlns:xsi="http://www.w3.org/2001/XMLSchema-instance">
<typeId root="2.16.840.1.113883.1.3" extension="POCD_HD000040"/>
<id extension="13234453645" root="2.16.840.1.113883.2.6.15.3.427.1"/>
<title>Pathologisch anatomische Begutachtung [mit kritischer Stellungnahme]</title>
<code code="11526-1" codeSystem="2.16.840.1.113883.6.1"/>
<effectiveTime value="200509241634"/>
<!-- CDA Header -->
... siehe Beschreibung CDA R2 Header
<!-- CDA Body -->
<component>
<structuredBody>
... siehe Beschreibung CDA R2 Body
</structuredBody>
</component>
</ClinicalDocument>
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Patient
| Template ID | 1.2.276.0.76.3.1.131.1.10.2.7 ???? | |
| General Description | In diesem Abschnitt im CDA Header wird der Patient beschrieben/erfasst. Dieser setzt sich zusammen aus einer Patientenrolle sowie dem Patienten selbst. Diese werden im recordTarget zusammengeführt. | |
| LOINC Code | Opt. | Description |
| ???? | O | |
Im CDA-Header muss mindestens eine Patientenrolle beschrieben sein, die genau von einer Person gespielt wird.
| Lvl | RIM | Name | Desc | DT | Kard | Conf | Beschreibung |
|---|---|---|---|---|---|---|---|
| 1 | part | recordTarget | Patient | 1..1 | required | ||
| 2 | role | patientRole | Patient | 1..1 | required | Die Rolle des Patienten wird durch eine Person gespielt.
| |
| 3 | role | id | ID des Patienten | 1..1 | required | Verpflichtend muss in diesem Bereich die Patientenidentifikationsnummer angegeben werden. Diese setzt sich zusammen aus dem @extension Attribut, das die ID des Patienten enthält sowie dem @root Attribut, das die OID des Systems enthält, das die ID vergeben hat.
| |
| 4 | role | extension | ID des Patienten | 1..1 | required | ||
| 4 | role | root | ID des Patienten | 1..1 | required |
| |
| 3 | ent | Person | 0..1 | optional | Patient | ||
| 4 | ent | name | Name des Patienten | 0..1 | optional | In dem Attribut @name ist der Name des Patienten untergebracht. Der Name wird wiederrum unterteilt in die @given und @family Attribute, die den Vornamen und den Familiennamen des Patienten enthalten. |
Ein kompletter recordTarget ist im Folgenden angegeben.
<recordTarget>
<!--- Patienten-Daten -->
<patientRole>
<id extension="6245" root="2.16.840.1.113883.3.933"/>
<patient>
<name>
<prefix>Dr.</prefix>
<given>Paul</given>
<family>Pappel</family>
</name>
</patient>
</patientRole>
</recordTarget>
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Autor
| Template ID | 1.2.276.0.76.3.1.131.1.10.2.7 ???? | |
| General Description | Autor des Berichts | |
| LOINC Code | Opt. | Description |
| ???? | O | |
| Lvl | RIM | Name | Desc | DT | Kard | Conf | Beschreibung |
|---|---|---|---|---|---|---|---|
| 1 | part | author | Autor | 1..1 | required | Autor: Neben dem Patienten muss ein Autor (author) angegeben werden, welcher das Dokument verfasst hat. | |
| 2 | part | time | Zeitpunkt | TS | 1..1 | required | Im verpflichtend anzugebenden @time Attribut wird der Zeitpunkt der Dokumentation angegeben. |
| 2 | role | author | Autor | 1..1 | required | Informationen über den Autor werden in der assignedAuthor Klasse angegeben. | |
| 4 | ent | name | Name des Autors | PN | 0..1 | optional | In dem Attribut @name ist der Name des Autors untergebracht. Der Name wird wiederum unterteilt in die @given und @family Attribute, die den Vornamen und den Familiennamen des Autors enthalten. |
Ein kompletter author ist im Folgenden angegeben.
<author>
<time value="20050829"/>
<assignedAuthor>
<id extension="190388km89" root="2.16.840.1.113883.3.24535"/>
<assignedPerson>
<name>
<prefix>Dr.med.</prefix>
<given>Theo</given>
<family>Phyllin</family>
</name>
</assignedPerson>
</assignedAuthor>
</author>
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Verwaltende Organisation
| Template-Metadaten | |
| Template-Typ | Header |
| Template ID | 1.2.276.0.76.3.1.131.1.10.2.7 ???? |
| generischeres Template | |
| genutztes Templates | |
| nutzende Templates | |
| abgeleitete Templates | |
| Schwester-Templates | |
| Generelle Beschreibung | Dieses Template spezifiziert, wer das Dokument verwaltet. |
| allg. Erläuterung | |
| Verhältnis zu IHE | |
| Ballotierungsstatus | in Arbeit |
| Erweiterbarkeit | offen oder geschlossen |
| Lvl | RIM | Name | DT | Kard | Conf | Beschreibung |
|---|---|---|---|---|---|---|
| 1 | part | custodian | 1..1 | R | verwaltende Organisation | |
| 2 | part | @typeCode | 1..1 | F | "CST" | |
| 2 | role | assignedCustodian | 1..1 | M | ||
| 3 | role | @classCode | 1..1 | F | ASSIGNED | |
| 3 | ent | representedCustodianOrganization | 1..1 | M | Organisation | |
| 4 | role | id | 1..1 | M | Identifikation
| |
| 4 | role | name | 0..1 | O | Name der Organisation |
Die Organisation (custodian), die für die Verwaltung des Dokuments verantwortlich ist, muss verpflichtend in der entsprechenden Klasse wiedergegeben werden.
Die Organisation muss mindestens mit einer ID gekennzeichnet werden.
Ein kompletter custodian ist im Folgenden angegeben.
<custodian typeCode="CST">
<assignedCustodian classCode="ASSIGNED">
<representedCustodianOrganization>
<id extension="175648374" root="1.2.276.0.76.4.5"/>
<name>
...
</name>
</representedCustodianOrganization>
</assignedCustodian>
</custodian>
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
CDA Body
Die eigentliche klinische Dokumentation wird im so genannten CDA Body festgehalten. Im Vordergrund steht hier „lesbarer" (narrativer) Text, der verpflichtender Bestandteil von CDA R2 Dokumenten ist und die Interoperabilität zwischen den menschlichen Kommunikationspartnern garantiert. Hier sind Möglichkeiten gegeben, diesen Text grob zu strukturieren, wie man dies von den Möglichkeiten der Textverarbeitung her kennt. Zur Strukturierung stellt die Standardspezifikation eine Reihe von XML-Elementen zur Verfügung, die als Body Structures zusammengefasst werden können. Der Body enthält ein oder mehrere Abschnitte (sections). Diese können auch ineinander geschachtelt sein, so wie Kapitel und Unterkapitel in einem Buch. Zudem sind Strukturierungen im textuellen Bereich im Sinne von Tabellen oder Listen möglich.
- Abschnitte <section>
- Paragrafen <paragraph>
- Kennzeichnung von bestimmten Inhalten <content>
- Überschriften <caption>
- Tabellen <table>
- Listen <list>
Sections enthalten immer einen narrativen Block und erfüllen damit eine der oben genannten Maximen von CDA: die Mensch-zu-Mensch-Interoperabilität, die Lesbarkeit der Informationen für den Menschen. Im narrativen Block, durch das Textattribut in der section-Klasse repräsentiert, wird eingebetteter Text innerhalb eines Abschnittes angegeben. Dabei kann mit oben genanntem <content> Element bestimmter Inhalt gesondert gekennzeichnet werden.
Zusammengefasst werden im Textblock (teils so auch schon in CDA Release 1 realisiert) u.a. folgende Möglichkeiten der Struktur- und Formgebung des fließenden Textes gegeben:
- Zeilenumbrüche <br>
- Stilistische Angaben (unterstreichen, fett, kursiv etc.)
- Hoch- und Tiefstellung von Text
- Fußnoten
- Symbole
- Revisionsmarken im Text wie <delete>, <insert>
Mit den beschriebenen Body Strukturen können CDA Entries verbunden sein. Diese repräsentieren den „computerlesbaren Teil" innerhalb eines Dokumentenabschnitts. Body Entries sind im Prinzip eine Auswahl aus Klassen mitsamt Attributen aus dem HL7 Referenz-Informationsmodell (RIM).
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
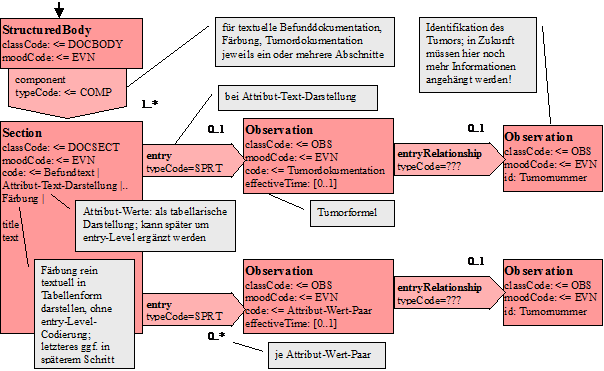
Modell
Nachfolgend ist das CDA-Modell angegeben, so wie es für den Pathologie-Bericht instanziiert wird:
Abbildung 5: Level-3-Modell
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Beispiele für Befunde
Zu Beginn ein relativ einfaches und kurzes Beispiel:
Material:
Zystenbalg Regio 38
Makroskopische Beurteilung:
Zusammen pampelmusenkerngroße (Durchmesser 12 mm) membranöse festelastische grauweißliche Gewebsstücke.
Mikroskopische Beurteilung:
Partiell durch ein sehr schmales, nicht verhorntes Plattenepithel ausgekleideter Balganteil einer odontogenen Zyste mit einzelnen Malassezschen Epithelnestern und herdbetonter sehr schütterer rundzelliger entzündlicher subepithelialer Infiltration. Eingesprengt wenig Hartmaterial.
Diagnose:
Follikuläre Zyste. Kein Anhalt für Malignität oder Spezifität am vorliegenden Material.
Unterschrift
Material:
Sonographisch gestützte Stanzbiopsie Mamma re. 10 Uhr
Makroskopische Beurteilung:
Mehrere (gemäß klinischer Angabe fünf) zusammen 51 mm lange weiche bis mittelfeste teils grauweißliche, teils graugelbliche Punktionszylinder von max. Bleistiftminenstärke.
Mikroskopische Beurteilung: (HE, CK 5/14, CK 7):
Alle gewonnenen Punktionszylinder wurden vollständig gebettet und mit 13 Schnittstufen untersucht. Sie bestehen aus lipomatös und fibrolipomatös transformiertem Brustdrüsengewebe und lassen in mindestens sechs Punktionszylinderteilstücken neben atrophischen Drüsenlobuli und ektatischen Milchgangsanschnitten sowie kleineren Adenoseherden (mikrozystische und blunt-duct-Adenosen) in wechselnder Dichte in ein hyalinelastotisch transformiertes Stroma eingebettete unterschiedlich großkalibrige Tubuli erkennen, diese vielfach mit Abknickungen, die ausgekleidet werden von einem einreihigen, überwiegend gering, örtlich mäßig atypischen flach kubischen Epithel ohne nennenswerte mitotische Aktivität und fehlende basale Myoepithellage in der CK 5/14-Reaktion, vereinbar mit Tumorinfiltraten eines tubulären Mammakarzinoms (Malignitätsgrad 1 nach Elston und Ellis; 1+2+1); vgl. auch EH-Nr. 7082/12.
Diagnose: Tubuläres Karzinom der Mamma.
Klassifikation nach NHSBSP: B 5b
Zum Ergebnis der noch ausstehenden Hormonrezeptorbestimmung und des HER-2/neu- Status erfolgt ein Nachbericht. Telefonische Vorabinformation am 31.05.2012.
Unterschrift
1. Nachbericht:
Ergebnis der immunhistochemischen Hormonrezeptorbestimmung:
Östrogenrezeptoren: über 80 % positiver Zellkerne, vorherrschende Färbeintensität: stark, IRS 12 nach Remmele und Stegner.
Progesteronrezeptoren: über 80 % positiver Zellkerne, vorherrschende Färbeintensität: stark, IRS 12 nach Remmele und Stegner.
Der Tumor ist endokrin-responsiv.
Ergebnis der in-situ-Hybridisierung (BDISH) des HER2-neu-Gens:
Nach einer in-situ-Hybridisierung des Genlocus c-erb-B2 und des Zentromer von Chromosom 17 wurden die ISH-Signale von 30 Tumorzellen ausgezählt. Die untersuchten invasiven Tumorzellen zeigen ein mittleres Verhältnis 1,19 (Gen/Zentromer). Es liegt also keine Amplifikation des HER2-neu Lokus vor (ZytoDot 2C SPEC Her- 2/CEN17 Probe Kit).
Unterschrift
Material:
1. Sentinel-LK re. 2. Segmentresektat Mamma re.
Makroskopische Beurteilung:
1. Backpflaumengroßes (40 x 20 x 15 mm messendes) Fettgewebsstück, darin
eingeschlossen drei, max. gewürzkorngroße (größter Durchmesser 6 mm) mittelfeste
grauweißliche Gewebsknoten.
2. Auf Styroporplatte nadelfixiertes, zweifach fadenmarkiertes fettgewebsreiches
Mammaresektat aus dem zentralen Drüsenkörper von 119 g in einer Ausdehnung
von 6,5 x 7 x 4 cm mit zentral aufsitzender, 4 cm durchmessender Mamille/Areole.
Mamille und unmittelbar retromamilläres Drüsenkörpergewebe in einer Ausdehnung
von 12 mm derb knotig grauweiß induriert. Auf der Mamille selbst aufgelagert
eine kleine Kruste.
Das Resektat wird von lateral beginnend in neun Scheiben lamelliert. Weitere
verdächtige Knotenbildungen kommen nicht zur Darstellung.
Sicherheitszonen der beschriebenen Knotenbildungen zu allen Resektionsrändern
mindestens 10 mm bzw. deutlich darüber.
Schnellschnittdiagnose:
1. Alle drei Sentinellymphknoten im Schnellschnitt metastasenfrei.
2. Karzinom unmittelbar retromamillär, Sicherheitszonen nach allen Seiten
mindestens 10 mm bzw. deutlich darüber.
Telefonische Befundübermittlung am 15.06.2012, 11.59 Uhr an Herrn CA Dr. XY.
Mikroskopische Beurteilung:
1. Alle drei Sentinellymphknoten, die vollständig gebettet und in Stufenserienschnitten
mit jeweils 12 Schnittstufen aufgearbeitet wurden, sind metastasenfrei.
Man erkennt kleinherdige lipomatöse Transformationen und narbige Fibrosierungen.
Umgebendes Fettgewebe unauffällig.
2. Das Mammaresektat wurde unter Berücksichtigung der Topografie und Markierungen mit 13 Paraffinblöcken mit jeweils Schnittstufen untersucht. In der Haut der Mamillenregion bzw. unmittelbar retromamillär unter Einbeziehung der lokalisationstypisch größeren Ductus und Sinus lacteripheri Tumorgewebe des in der Stanzbiopsie vordiagnostizierten invasiven Mammakarzinoms (vgl. EH-Nr. 7226/12), jetzt als gemischt invasiv duktales und lobuläres Mammakarzinom zu klassifizieren (Malignitätsgrad 2 nach Elston und Ellis; 3+2+1) mit vordergründig dissolut einzelzelligem Wachstumsmuster mit Ausbildung sog. indian files und Targetstrukturen um unbeeinträchtigte Milchgänge, aber auch tubulären Differenzierungen und kleiner intraduktaler Komponente, die an umschriebener Stelle den invasiven Karzinomanteil nach dorsal um 1 mm überschreitet. Es besteht eine wechselnd stark ausgeprägte Stromasklerose mit örtlich schütter rundzellig entzündlicher Stromareaktion und man sieht in einem der Schnittpräparate eine umschriebene, herdförmig eingeblutete narbige Fibrose mit reaktiven Veränderungen der bedeckenden Epidermis bei Zustand nach vorausgegangener Punchbiopsie. Karzinomentfernung im Gesunden, Sicherheitszonen nach allen Seiten jeweils deutlich über 10 mm. Breit anhängender Saum tumorfreien Brustdrüsengewebes betont lipomatös transformiert ohne sonstigen nennenswerten pathologischen Befund.
Zusammenfassung:
Ungewöhnlich oberflächlich retromamillär bzw. in der Haut der Mamillenregion rechts gelegenes gemischt invasiv duktales und lobuläres Mammakarzinom. Karzinomentfernung im Gesunden (Sicherheitszonen nach allen Seiten über 10 mm). Drei metastasenfreie Sentinellymphknoten.
Unterbeauftragte Untersuchung:
Unfixiertes Tumorgewebe wurde zur uPA/PAI-1-Bestimmung an das Institut für Pathologie des UKD gesandt. Über das Ergebnis wird nachberichtet.
Tumorklassifikation:
TNM (UICC, 7. Auflage):
pT1c pN0 (0/3sn), R0, L0, V0
Grading:
G 2
ICD-O-3:
C 50.0, M 8522/3
Unterschrift
1. Nachbericht:
Ergebnis der uPA/PAI-1-Analyse:
Methodik: Am unfixierten Gewebe des invasiven Mammakarzinoms wurde nach Kryokonservierung mit dem FEMTELLE® ELISA-Test die Aktivität des Plasminogenaktivators vom Urokinasetyp (uPA) und des Plasminogen-Inhibitors (PAI-1) bestimmt (Institut für Pathologie des UKD, Prof. Dr. XYZ).
Untersuchungsergebnis:
uPA: 6,27 ng/mg Protein
PAI-1: 12,4 ng/mg Protein
Bewertung:
Bei diesem Ergebnis kann bei nodal-negativen Mammakarzinom, Malignitätsgrad 2 nach Elston und Ellis entsprechend der Interdisziplinären S3-Leitlinie für die Diagnostik, Therapie und Nachsorge des Mammakarzinoms von einem hohen Rezidivrisiko ausgegangen werden.
Unterschrift
Material:
Zystoprostatektomiepräparat, Absetzungsrand Harnröhre tumorfrei?
Makroskopische Beurteilung:
Zystoprostatektomiepräparat bestehend aus der im eröffneten Zustand 6,5 x 5,5 x 3 cm messenden Harnblase, der 5,0 x 3,5 x 3,0 cm messenden Prostata, einem 7 cm langen und maximal 0,3 cm durchmessenden Ureteranteil rechts, einem maximal 7 cm langen und maximal 0,3 cm durchmessenden Ureteranteil links, einem 8 cm langen Ductus deferens-Anteil der rechten Seite von maximal 4 mm Durchmesser sowie einem 8 cm langen Ductus deferens-Anteil der linken Seite von maximal 4 mm Durchmesser sowie der maximal 3 cm durchmessenden rechten Samenblase und der maximal 3 cm durchmessenden linken Samenblase. Der Harnrˆhrenabsetzungsrand ist fadenmarkiert. Im Bereich der rechten Harnblasenseitenwand/-hinterwand zeigt sich ein maximal 2,5 cm durchmessender ulkusartiger Defekt (a). Eindeutiges Tumorgewebe lässt sich makroskopisch nicht abgrenzen. Die Prostata ist von kleinknotigem Aufbau und weist kleinzystische Hohlraumbildungen auf. Im perivesikalen Weichgewebe lassen sich keine Gewebsknoten makroskopisch abgrenzen.
Schnellschnittdiagnose:
Tumorfreier Harnröhrenabsetzungsrand.Telefonische Befundübermittlung an Herrn CA Prof. Dr. Urologe um 10:54 Uhr am 27.03.2013.
Mikroskopische Beurteilung:
Das Zystoprostatektomiepräparat wurde mit 18 Paraffinblöcken und zahlreichen Schnittstufen histologisch untersucht. Im oben beschriebenen Bereich der Harnblase (a) finden sich partiell ulzerierte papilläre und solide urotheliale Karzinomstrukturen, die eine mäßige bis starke Kernpolymorphie aufweisen. Tumorinfiltration aller Harnblasenwandschichten, örtlich kleinherdig bis in das unmittelbar angrenzende perivasikale Fettgewebe reichend. Verschiedentlich Lymphangiosis carcinomatosa. In der angrenzenden Harnblasenschleimhaut sowie in der linken Harnblasenseitenwand und im Harnblasenscheitel fokale urotheliale Dysplasien aller Schweregrade bis zu einem Carcinoma in situ. Der Ureter am Resektionsrand beiderseits ist tumorfrei. In der Pars prostatica urethrae multifokales Carcinoma in situ mit Übergreifen auf von Brunnsche Zellnester. Hier keine Tumorinfiltration durch das Urothelkarzinom. Der Harnröhrenabsetzungsrand ist auch im paraffingebetteten Material tumorfrei. Im rechten Prostataseitenlappen finden sich herdförmig azinäre und tubuläre Karzinomstrukturen, die zwischen nicht neoplastische Drüsen infiltrieren sowie eine geringe bis mäßige Kernpolymorphie und prominente Nukleolen aufweisen. Apex prostatae sowie Ductus deferens und Samenblase beiderseits sind tumorfrei.
Diagnose:
Schlecht differenziertes Urothelkarzinom der Harnblase, im Gesunden entfernt. Verschiedentlich Lymphangiosis carcinomatosa. In der Tumorumgebung und in der Pars prostatica urethrae multifokales Carcinoma in situ.
Tumorklassifikation: (im Zusammenhang mit EH-Nr. 4259/13):
TNM (UICC, 7. Auflage): pT3a pN0 (0/17), L1, V0, R0
Grading: G 3, high grade
ICD-O-3: C 67, M 8130/33
Mäßig differenziertes azinäres Adenokarzinom im rechten Prostataseitenlappen, im Gesunden entfernt.
Tumorklassifikation: (im Zusammenhang mit EH-Nr. 4259/13):
TNM (UICC, 7. Auflage): pT2a pN0 (0/17), L0, V0, R0
Grading: Gleason-Score: 3+3=6, G IIa nach Helpap
ICD-O-3: C 61, M 8140/3
Unterschrift
PathoBerichtText
Wiederholung der Ki-67-Färbung von der 2. Fraktion (rechts).
Beurteilung
1. Isolierte Tumorzellen in einem funktionsgesteigerten Lymphknoten (linke Axilla Sentinellymphknoten 544cps).
2. Teils glanduläres, teils solides, invasives ductales Adenocarcinom der Brustdrüse, geringe nukleäre Atypien sowie ductales Carcinoma in situ mit geringen Atypien, DCIS I und Mikrokalk bis 0,2mm (rechte Mamma oben zwischen den Quadranten, Resektat); immunhistologisch fokal starke Expression des Östrogenrezeptors in etwa 60% der Tumorzellen.
Score nach Elston und Ellis: 4.
Immunreaktiver Score: Östrogenrezeptor 9, Progesteronrezeptor 0.
Onkoprotein C-erbB-2 Index: 0
Größter Durchmesser des invasiven Carcinoms etwa 9mm, das invasive Carcinom reicht zumindest an die craniale Abtragungsebene im peripheren (cranialen) Pol. Durchmesser der in situ Komponente etwa 35mm, Abstand von der nächstgelegenen (posterioren) Abtragungsebene etwa 0,4mm, die in situ Komponente breitet sich allerdings ebenfalls in den peripheren (cranialen) Pol aus und erreicht damit dort mindestens die Abtragungsebene.
3. Weitgehend solides, invasives ductales Adenocarcinom der Brustdrüse, mittelgradige, herdförmig schwere nukleäre Atypien, etwa in gleicher Größe ductales Carcinoma in situ mit schweren Atypien, DCIS III sowie Nekrosen und Verkalkungen bis 4mm (Resektat linke Mamma oben außen); immunhistologisch starke Expression des Östrogenrezeptors und des Progesteronrezeptors jeweils in etwa 85% der Tumorzellen. Immunreaktiver Score: Östrogenrezeptor 12, Progesteronrezeptor 12. Kleine Wachstumsfraktion (Ki-67 um 10 %). Onkoprotein C-erbB-2 (Her-2-Neu-Index: 0). Größter Durchmesser der invasiven Komponente und der in-situ-Komponente jeweils etwa 23mm. Abstand der invasiven Komponente von der nächstgelegenen Abtragungsebene (posterior) 3,2mm, Abstand von anterior 12mm, von cranial 20mm, von caudal 23mm, von medial 30mm, von lateral 13mm. Die in-situ-Komponente breitet sich zumindest bis an die posteriore Abtragungsebene aus.
4. Neun tumorfreie Lymphknoten (linke Axilla).
5. Tumorfreies Fettgewebe (linke Mamma, Nachresektat lateral).
6. Überwiegend tumorfreies Fettgewebe mit kleinen Anteilen von tumorfreiem Brustdrüsengewebe (linke Mamma, Nachresektat mamillenwärts).
7. Überwiegend tumorfreies Fettgewebe mit kleinen Anteilen von tumorfreiem Brustdrüsengewebe (linke Mamma, Nachresektat cranial).
Auch nach Wiederholung lässt sich die Wachstumsfraktion in dem kleinen Tumor auf der rechten Seite nicht darstellen, vermutlich wurde das Antigen durch die schwere thermische Schädigung zerstört.
Pathologiebefundbericht
| Template ID | 1.3.6.1.4.1.19376.1.8.1.1.1 (AP APSR 6.2.3.1) | |
| General Description | In diesem Template werden die Daten zum Pathologiebefundbericht übermittelt. | |
| Status | identisch zu IHE | |
| LOINC Code | Opt. | Description |
| 11526-1 | R | Pathology Study |
Definition und Zweck
Dieses Template definiert die Grundlage für die Einschränkungen jedes strukturierten Pathologiebefundberichts unabhängig von Organ oder Diagnose. Es ist damit das generische Template für jeden strukturierten Pathologiebefund in allen Gebieten der Pathologie (z.B. Entzündung, Degeneration, Kreislaufstörung, gut- und bösartige Tumoren) sowie Zytopathologie.
Die Hierarchie von Sections und Entries ist in der IHE-Abb. dargestellt. Die einzige obligatorische Section (R) ist die Diagnostische Schlussfolgerung Section, der einzige obligatorische Entry ist der Specimen Information organizer Entry in dieser Section.
CDA APSR_R2 (IHE): Hierarchy of the body for APSR document content module
Die Sections 1 bis 5 zeigen folgende Grundstruktur:
Die Section 6 (Materialbearbeitung / Procedure Steps) weicht davon ab:
APSR_Common_Structure_Section6.PNG
Beispiel
<ClinicalDocument xmlns='urn:hl7-org:v3'>
<typeId extension="POCD_HD000040" root="2.16.840.1.113883.1.3"/>
<templateId root='1.3.6.1.4.1.19376.1.8.1.1.1'/>
<id root='1.3.6.1.4.1.19376.1.8.9' extension='123'/>
<code code='11526-1' displayName='Pathology study'
codeSystem='2.16.840.1.113883.6.1' codeSystemName='LOINC'/>
<title>Anatomic pathology structured report</title>
<effectiveTime value='20100114153000-0700'/>
<confidentialityCode code='N' displayName='Normal' codeSystem='2.16.840.1.113883.5.25'/>
<languageCode code='en-US'/>
<!-- one patient -->
<recordTarget><patientRole> .. </patientRole></recordTarget>
<!-- one or more author -->
<author> .. </author>
<!-- one or more transcriptionists -->
<dataEnterer> .. </dataEnterer>
<!-- one or more person who provided useful information as input to this document -->
<informant> .. </informant>
<!-- the organization (laboratory) issuing this report and in charge with its lifecycle -->
<custodian> .. </custodian>
<!-- zero or more intended recipient other than the ordering physician (« copy to ») -->
<informationRecipient> .. </informationRecipient>
<!-- the person (lab director) legally responsible for this report, who may have signed it -->
<legalAuthenticator> .. </legalAuthenticator>
<!-- one or more pathologists who validated and/or corrected the content -->
<authenticator> .. </authenticator>
<!-- the ordering physician, and the date-time the order was issued -->
<participant typeCode='REF'> .. </participant>
<!-- zero or more distinct specimen collector, and the date-time the specimen was collected -->
<participant typeCode='DIST'> .. </participant>2
<inFulfillmentOf> .. </inFulfillmentOf>
<!-- The service documented and the primary laboratory having performed it -->
<documentationOf> .. </documentationOf>
<!-- zero or one encompassing encounter -->
<component><encompassingEncounter> .. </encompassingEncounter></component>
<!-- The body of the report -->
<component>
<structuredBody>
<component>
<section>
<templateId root='1.3.6.1.4.1.19376.1.8.1.2.1'/>
<code code='22636-5' displayName=’Pathology report relevant history'
codeSystem='2.16.840.1.113883.6.1' codeSystemName='LOINC'/>
<title>CLINICAL INFORMATION</title>
<text>
Tissue submitted: left breast biopsy and apical axillary tissue
</text>
<component>
<section>
<templateId root= '1.3.6.1.4.1.19376.1.5.3.1.3.1'/>
<code code='42349-1' displayName= ‘Reason for referral’
codeSystem='2.16.840.1.113883.6.1' codeSystemName='LOINC'/>
<title>Reason for anatomic pathology procedure</title>
<text>Breast mass - left breast</text>
</section>
</component>
<component>
<section>
<templateId root='1.3.6.1.4.1.19376.1.5.3.1.3.4'/>
<code code=’10164-2’ displayName= ‘History of present illness’
codeSystem='2.16.840.1.113883.6.1' codeSystemName='LOINC'/>
<title> History of present illness </title>
<text>Carcinoma of breast. Post operative diagnosis: same.
left UOQ breast mass.
</text>
</section>
</component>
</section>
</component>
<component>
<section>
<templateId root='1.3.6.1.4.1.19376.1.8.1.2.2'/>
<code code='TBD' displayName='intraoperative section in anatomicpathology report'
codeSystem='2.16.840.1.113883.6.1'codeSystemName='LOINC'/>
<title>INTRAOPERATIVE OBSERVATION</title>
<text> </text>
<entry> </entry>
</section> </component>
<component>
<section>
<templateId root='1.3.6.1.4.1.19376.1.8.1.2.3'/>
<code code='22634-0' displayName='Pathology report gross observation'
codeSystem='2.16.840.1.113883.6.1' codeSystemName='LOINC'/>
<title>MACROSCOPIC OBSERVATION</title>
<text> </text>
<entry> <entry/>
:
</section>
</component>
<component>
<section>
<templateId root='1.3.6.1.4.1.19376.1.8.1.2.4'/>
<code code='22635-7' displayName='Pathology report microscopic observation'
codeSystem='2.16.840.1.113883.6.1' codeSystemName='LOINC'/>
<title>MICROSCOPIC OBSERVATION</title>
<text> </text>
<entry> <entry/>
:
</section>
</component>
<component>
<section>
<templateId root='1.3.6.1.4.1.19376.1.8.1.2.5'/>
<code code='22637-3' displayName='Pathology report diagnosis'
codeSystem='2.16.840.1.113883.6.1' codeSystemName='LOINC'/>
<title>DIAGNOSTIC CONCLUSION SECTION</title>
<text> </text>
<entry> <entry/>
:
</section>
</component>
<component>
<section>
<templateId root='1.3.6.1.4.1.19376.1.8.1.2.6'/>
<code code='46059-2' displayName=' Special treatments and procedures section '
codeSystem='2.16.840.1.113883.6.1' codeSystemName='LOINC'/>
<title>PROCEDURE STEPS SECTION</title>
<text> </text>
<entry> <entry/>
:
</section>
</component>
</structuredBody>
</component>
</ClinicalDocument>
Spezifikation
Die Spezifikation des Header-Abschnitts ist in jenem Abschnitt beschrieben.
 |
Inwieweit die sehr umfangreiche Header-Spezifikation von IHE damit weiter eingeschränkt werden soll, muss entschieden werden. GH |
In folgender Tabelle ist die Spezifikation des Body ausgeführt.
| Datenelement | Verw. | Kard. | Path and Constraints (Xpath + indentation) | Vokabular / Quelle | Bemerk. | DT | HL7 V2.5.1 |
| Report body | R | [1..1] | component/structuredBody | ||||
| Anrede Section | O | [0..1] | component/section
templateId[@root="2.999.889.777.22.77.10.10"] |
11 | |||
| Klinische Information Section | R2 | [0..1] | component/section
[/templateId/@root="1.3.6.1.4.1.19376.1.8.1.2.1"] |
PAT TF-3: 6.2.4.1 | 12 | OBR-13 | |
| Intraoperative Untersuchung
Section |
R2 | [0..1] | component/section
[/templateId/@root="1.3.6.1.4.1.19376.1.8.1.2.2"] |
PAT TF-3: 6.2.4.2 | 13 | ||
| Makroskopische Untersuchung
Section |
R2 | [0..1] | component/section
[/templateId/@root="1.3.6.1.4.1.19376.1.8.1.2.3"] |
PAT TF-3: 6.2.4.3 | 14 | ||
| Mikroskopische Untersuchung
Section |
R2 | [0..1] | component/section
[/templateId/@root="1.3.6.1.4.1.19376.1.8.1.2.4"] |
PAT TF-3: 6.2.4.4 | 15 | ||
| Diagnostische Schlussfolgerung Section | R | [1..1] | component/section
[/templateId/@root="1.3.6.1.4.1.19376.1.8.1.2.5"] |
PAT TF-3: 6.2.4.5 | 16 | ||
| Materialaufbereitung Section | R | [1..1] | component/section
[/templateId/@root="1.3.6.1.4.1.19376.1.8.1.2.6"] |
PAT TF-3: 6.2.4.6 | 17 | ||
| Schlusstext Section | O | [0..1] | component/section
templateId[@root=" ????? "] |
18 |
Bemerkungen:
(11): Die Anrede ist in DE im Pathologiebefund optional. Wenn vorhanden, wird sie wie im Arztbrief behandelt.
(12): Die Klinische Information Section enthält die Angaben des einsendenden Arztes: Anamnese, prä- und postoperative Diagnosen, Laborwerte, Probenbenennung, Probengewinnung, Fragestellung.
(13): Die Inraoperative Untersuchung Section enthält die Intraoperative (Gefrierschnitt-)Diagnose für jedes untersuchte Material, die Probenbeschreibung und die Benennung der intraoperativen Untersuchungsverfahren sowie für Spezialuntersuchungen abgezweigte Probenteile (z.B. Durchflusszytometrie, Zytogenetik, molekularpathologische Untersuchungen, Elektronenmikroskopie).
(14): Die Makroskopische Beschreibung Section enthält die Beschreibung aller erhaltenen Proben (Probentyp und -zustand), Links zu Makrofotos, die prozessurale Beschreibung und die Gewebsverwendung für zusätzliche Untersuchungsverfahren sowie die versendung in Biobanken.
(15): Die Mikroskopische Beschreibung Section enthält die histopathologischen Befunde zusammen mit den ergebnissen der zusätzlichen Untersuchungsverfahren (z.B. Histochemie, Immunhistochemie, Molekularpathologie).
(16): Die Diagnostische Schlussfolgerung Section enthält die Diagnosen aller eingesandten Proben eines Falles. Sie werden für jede Probe oder jede gruppe von Proben separat dargestellt. Die Section schließt zusätzliche Untersuchungsbefunde, Diagramme, statische bilder und Virtual Slides ein. Sie sammelt den minimalen Satz für die Diagnose relevanter Informationen.
(17): Die Materialaufbereitung (Procedure Steps) Section enthält die Beschreibung des eingesandten Materials, die Auflistung der zu beantwortenden Probleme, sowie der Gewebsaufarbeitung hinsichtlich repräsentativer Proben und davon abgeleitete Proben für zusätzliche Untersuchungsmethoden oder Biobanken. Eine Problemauflistung wird in deutschen Pathologiebefunden textlich nicht vorgenommen, sie bestimmt aber weitgehend die Struktur und den Umfang des Befundtextes. Sie muss in dieser Section auf Entry-Level vorhanden sein. Die Gewebsaufarbeitung ist in deutschen Pathologiebefunden optional.
(18): Der Schlusstext ist in DE im Pathologiebefund optional. Wenn vorhanden, wird er wie im Arztbrief behandelt.
Dieses Material ist Teil des Leitfadens Implementierungsleitfaden.
|
Anhang A: Diverses
Dokumentenhistorie
| Version | Stand | Bearbeiter | Beschreibung | Dok.-OID |
|---|---|---|---|---|
| 2014 | GH + FO | Layout, Tabellendarstellung, Umstrukturierung, Sections, Entries, Vokabularien, Dokumenttypen, Abgleich mit IHE-AP und HL7-AP | n.a. | |
| 19.10.12 | FO | Layout, Tabellendarstellung, Umstrukturierung | n.a. | |
| 18.10.12 | GH | Detailinfos | n.a. | |
| 06 | 13.04.12 | FO et.al. | Wikifizierung + Überarbeitung: Neustrukturierung | n.a. |
| 05 | 23.02.10 | FO | Überarbeitung: Neustrukturierung | n.a. |
| 04 | 16.11.09 | FO | Überarbeitung: Neustrukturierung | n.a. |
| 03 | 15.09.09 | FO | Überarbeitung | n.a. |
| 02 | 08.07.09 | FO | Überarbeitung | n.a. |
| 01 | 23.06.09 | IR | Dokument erstellt | n.a. |
Kollaboratives Werkzeug von IHE APSR
Durch IHE AP wurde für die APSR-Entwicklung, speziell die weitere Entwicklung der Interface-Terminologie PathLex, folgendes Werkzeug in einer beta Version zur verfügung gestellt:
http://termapp.davidouagne.com
Organspezifischer Pathologiebefundbericht
| Template ID | 1.3.6.1.4.1.19376.1.8.1.1.2.1 - 20 (AP APSR 6.2.3.2) | |
| General Description | In diesem Template werden die Daten zum organspezifischen Pathologiebefundbericht übermittelt. | |
| Status | identisch zu IHE | |
| LOINC Code | Opt. | Description |
| 11526-1 | R2 | Pathology Study |
Definition und Zweck
Dieses Template definiert bisher die Grundlage für die organspezifischen Einschränkungen von strukturierten Pathologiebefundberichten mit Tumordiagnosen. Das Parent Template ist 1.3.6.1.4.1.19376.1.8.1.1.1 (Pathologiebefundbericht), von dem es alle Eigenschaften erbt. Zukünftig wird es nur ein generisches Parenttemplate geben, in das durch verschiedene Problem organizer Templates generische oder läsionsspezifische AP Observation Templates eingebunden werden können. Diese sind durch eine Ontologie (OntoPathLex) definiert.
Beispiel
<ClinicalDocument xmlns='urn:hl7-org:v3'>
<typeId extension="POCD_HD000040" root="2.16.840.1.113883.1.3"/>
<!-- conformance to a generic APSR content module -->
<templateId root='1.3.6.1.4.1.19376.1.8.1.1.1'/>
<!-- conformance to a breast content module -->
<templateId root='1.3.6.1.4.1.19376.1.8.1.1.2.1'/>
<!-- remainder of the header not shown, similar to the header content of a generic APSR -->
<component>
<structuredBody>
<!—Same hierarchy of sections and entries as in generic APSR -->
</structuredBody>
</component>
</ClinicalDocument>
Spezifikation
Die organspezifischen Document Content Module berücksichtigen die Hierarchie von <section> und <entry> Elementen des generischen Document Content Moduls sowie die Beschränkungen ihrer Parent-Templates.
Jedes organspezifische Document Content Modul besteht aus einer Vokabularsatzbeschränkung für die Content Module "AP Observation" und "Specimen Collection Procedure", welche in jedem der <entry> Elemente dieses Document Content Moduls verschachtelt sein können.
Insbesondere werden die organspezifischen Observations bezüglich invasiver und nichtinvasiver maligner Tumoren anhand von sog. Cancer Checklists (z.B. CAP, deutsche S3-Leitlinien, Empfehlungen der Dt.Ges.f.Pathologie, etc.) spezifiziert. Die dazugehörigen Value sets sind im APSR Value Sets Appendix aufgeführt. Für den deutschsprachigen Raum werden diese weiter ergänzt bzw. ihre Verwendung begrenzt (National Extension).
Offene Punkte
- Codesysteme vervollständigen
- fehlende Abschnitte:
- n.n.
- Elemente und Attribute vollständig auflisten (inkl. Wikifizierung)
- Abgleich mit IHE Anatomic Pathology APSR und HL7 Anatomic Pathology
- ..
Referenzen/Literatur
| DIMDI, Alpha_Id: | Alpha-ID - Die Identifikationsnummer, http://www.dimdi.de/static/de/ehealth/alpha-id/index.htm |
| DIMDI, Verschl: | Anleitung zur Verschlüsselung, http://www.dimdi.de/static/de/klassi/diagnosen/icd10/icdsgbv20.htm |
| DIMDI, Basis: | Basiswissen Codieren, DIMDI 2004 |
| BMGS, 2004: | ICD-10-Bekanntmachung des BMGS, http://www.zi-berlin.de/Zi_ICD10Browser/zi_icd_10_browser.htm |
| InEK, Codierrichtlinien: | Deutsche Codierrichtlinien – Version 2005, Institut für Entgeltsystem im Krankenhaus (InEK gGmbH) 2004, http://www.g-drg.de/service/download/veroeff_2005/DKR2005_Endversion_PDF30_040916_1500.pdf |
| HL7 Datentypen: | HL7 Version 3 Datentypen und CMETs für das Deutsche Gesundheitswesen, www.hl7.de (Publikationen) |
| CDAr2Arztbrief: | Arztbrief auf Basis der HL7 Clinical Document Architecture Release 2 für das deutsche Gesundheitswesen, Version 1.50 vom 12.05.2006, herausgegeben vom VHitG, HL7 Deutschland und der Arbeitsgemeinschaft Sciphox, www.hl7.de (Publikationen)
http://www.hl7.de/download/documents/cdar2-arztbrief/Leitfaden-VHitG-Arztbrief-v150.pdf |
| Wiley: | TNM-System: Wiley Interscience |
Zeitangaben
In einem Bericht tauchen mehrere Zeitangaben auf, die hier einmal in Form einer Übersicht dargestellt werden sollen. Die Angaben in der Bedingung beziehen sich auf die Nummern aus der ersten Spalte, d.h. hierüber wird eine Reihenfolge etabliert:
| # | Datum | Art | Bedingung (bezogen auf #) |
im Krankenhaus | im Labor | HL7 V3 (CDA später) |
|---|---|---|---|---|---|---|
| 1 | Auftragserfassung | Beginn | x | Order | ||
| 2 | Auftragserfassung | Ende | 1 < 2 | x | ||
| 3 | Auftragsfreigabe | TS | 2 < 3 | x | ||
| 4 | Auftragsübermittlung | TS | 3 < 4 | x | ||
| 5 | Probenentnahme | von/bis | x | Specimen Specimen Collection Process | ||
| 6 | Probenversand (Ausgang) | TS | 5 < 6 | x | ||
| 7 | Auftragseingang | TS | 4 < 7 | x | Acknowledgement | |
| 8 | Auftragsbestätigung | TS | 7 < 8 | x | Promise | |
| 9 | Probeneingang | TS | 6 < 9 | x | Specimen-> Specimen Process Step | |
| 10 | Probenuntersuchung | Beginn | 9 < 10 7 < 10 |
x | documentationOf ServiceEvent->
Specimen | |
| 11 | Probenuntersuchung | Ende | 10 < 11 | x | ||
| 12 | Befundung | Beginn | 10 < 12 | x | Specimen-> ObservationEvent
author.time | |
| 13 | Befundung | Ende | 12 < 13 | x | ||
| 14 | Niederschrift Befund | Beginn | 13 < 14 | x | dataEnterer.time | |
| 15 | Niederschrift Befund | Ende | 14 < 15 | x | ||
| 16 | Freigabe Befund | TS | 15 < 16 | x | legalAuthenticator .time | |
| 17 | Übermittlung Befund | TS | 16 < 17 | x | Wrapper | |
| 18 | Befundeingang | TS | 17 < 18 | x | Wrapper | |
| 19 | Befund gelesen | TS | 18 < 19 | x | - |
Freigaben können mehrstufig erfolgen.
Mehrere Berichte in Abhängigkeit des Prozessschrittes
Attribut-Wert-Paare
Die Attribut-Wert-Paare werden textuell aus den codierten Informationen abgeleitet (derived).
Hierzu gehören auch die Cancer Checklists.
Die zu verwendenden Vokabularien sind im Anhang detailliert aufgelistet.
Die Informationen werden als Attribut-Wert-Paare in Form einer Tabelle dargestellt, die wie folgt aussieht.
| Entnahme | Resektat |
|---|---|
| Kalk histologisch | Ja |
| Kalk (mm) | 0,2 |
Oder in XML:
<section>
<!-- Darstellung als Tabelle -->
<text>
<tbody>
<tr>
<td><content ID="d1">Entnahme</content></td>
<td>Resektat</td>
</tr>
<tr>
<td><content ID="d2">Kalk Histologisch</content></td>
<td>Ja</td>
</tr>
<tr>
<td><content ID="d3">Kalk (mm)</content></td>
<td>0,2</td>
</tr>
...
</tbody>
</text>
<!-— erste Information -->
<entry typeCode="DRIV">
<observation classCode="OBS" moodCode="EVN">
<code code"Mamma.Entnahme" codeSystem="??????" />
<value xsi:type="CD" code="Resektat" codeSystem="????">
<originalText><reference value="#d1"/></originalText>
</value>
</observation>
</entry>
<!-— zweite Information -->
<entry typeCode="DRIV">
<observation>
<code code="Mamma.Kalk Histologisch" codeSystem="??????" />
<value xsi:type="BL" code="true">
<originalText><reference value="#d2"/></originalText>
</value>
</observation>
</entry>
<!-— dritte Information -->
<entry typeCode="DRIV">
<observation classCode="OBS" moodCode="EVN">
<code code="Mamma.Kalk"
codeSystem="a.b.c.dx.y.z"
displayName="Kalk" />
<value xsi:type="PQ" value="0,2" unit="mm" >
<originalText><reference value="#d3"/></originalText>
</value>
</observation>
</entry>
<!—weitere Information -->
...
</section>
Anlagen
Digitale Bilder
Makroskopische sowie mikroskopische Bilder und Virtual Slides müssen eingebunden werden können. Lösungen über DICOM Supplement 122: Specimen Module and Revised Pathology SOP Classes